常温下,下列有关0.1mol·L-1 Na2CO3溶液的说法正确的是
A.升高温度,促进CO32-水解,pH增大
B.离子浓度:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
B.离子浓度:c(Na+)+c(H+) =c(HCO3-)+c(CO32-) +c(OH-)
D.离子浓度:c(Na+)> c(CO32-)>c(H+)>c(OH-)> c(HCO3-)
室温下,下列叙述正确的是(溶液体积变化忽略不计)
| ① |
② |
③ |
④ |
|||||
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
||||
| pH |
11 |
11 |
3 |
3
|
下列根据反应原理设计的应用,不正确的是
A.CO32- + H2O 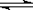 HCO3-+ OH-热的纯碱溶液清洗油污 HCO3-+ OH-热的纯碱溶液清洗油污 |
B.Al3+ + 3H2O 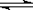 Al(OH)3 +3H+明矾净水 Al(OH)3 +3H+明矾净水 |
C.TiCl4+(x+2)H2O(过量)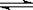 TiO2·x H2O↓ + 4HCl用TiCl4制备TiO2 TiO2·x H2O↓ + 4HCl用TiCl4制备TiO2 |
D.SnCl2 + H2O 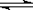 Sn(OH)Cl↓ + HCl配制 Sn(OH)Cl↓ + HCl配制 氯化亚锡溶液时加入氢氧化钠 氯化亚锡溶液时加入氢氧化钠 |
下列按电负性减小顺序排列的是
| A.N、O、F | B.N、P、As | C.K、Na、Li | D.Cl、O、H |
下列化合物中只含有2个手性碳原子的是

“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。下列说法合理的是
A.依据等电子原理  N2O与Si N2O与Si O2分子具有相似的结构(包括电子式) O2分子具有相似的结构(包括电子式)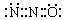 |
B.已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示 |
| C.N2O与CO2互为等电子体,因此不含非极性键。 | |
| D.N2O为角形分子 |