(14分)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
a、写出由磷酸钙矿制取白磷总的反应方程式_____________________________。
b、上述反应中SiO2起何作用?______________________________________。
(2)白磷在热的浓氢氧化钾溶液中岐化得到一种次磷酸盐(KH2PO2)和一种气体 (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在 之间(已知磷酸的各级电离常数为:K1= 7.1×10−3 K2 = 6.3×10−8 K3 =4.2×10−13 lg7.1≈0.9 lg6.3≈0.8 lg≈0.6) 。Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是 (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。
在t℃时,某NaOH稀溶液中,C(H+)=10-a mol/L,C(OH-)=10-b mol/L,已知a+b=12,
则:
(1)该温度下,水的离子积常数Kw= ;(具体数值)
(2)该温度下,将100mL 0.1mol/L的稀硫酸与100mL 0.4mol/L的NaOH溶液混合(混合时溶液体积的变化忽略不计)后,溶液的pH= ,此时该溶液中由水电离的C(OH-)= mol/L;
(3)该温度下,CH3COOH和CH3COONa的混合溶液,若测得混合液的PH=6,则溶液中:C(CH3COO-)-C(Na+)= 。(具体数值)
铁及其化合物之间的相互转化可用下式表示: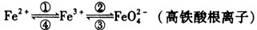
回答下列有关问题:
(1)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。
元素铁的原子结构示意图是 ;
(2)检验硫酸铁溶液中是否存在Fe2+的方法是 ;
(3)
(4)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+。Na2FeO4之所以能净水,除了能消毒杀菌外,另一个原因是(用离子方程式说明) 。
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、
E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。
A原子的最外层电子数比次外层电子层多3个。D周期序数等于D原子最外层电子数。
E原子半径是同周期中最小的(除稀有气体外)根据以上信息回答下列问题:
(1)A元素在周期表中的位置 ;
(2)乙物质中存在的化学键类型是 ;
(3)写出C与D的最高价氧化物对应的水化物相互间反应的离子方程式 ;
(4)E的单质通入C的最高价氧化物对应的水化物的溶液中反应生成的“84”消毒液的有效成分的化学式为 。
湖南盛产的山苍子油中柠檬醛含量很高,质量分数可达到60%-90%,柠檬醛也可以利用异戊二烯为原料人工合成,柠檬醛又可用来合成紫罗兰酮等香精香料,其合成路线如下:


已知:
①
②
③同一碳原子连有两个双键结构不稳定。
试根据上述转化关系回答下列问题:
(1)写出A的结构简式 ,C的结构简式 。
(2)①对应的反应条件是 ,反应③的反应类型是 。
(3)写出B转化为柠檬醛的化学方程式 。
(4)根据反应②的反应机理写出CH3CHO与足量的HCHO反应产物的结构简式: 。
(5)检验柠檬醛中含有碳碳双键的实验方法是: 。
(6)α-紫罗兰酮、β-紫罗兰酮有很多同分异构体,则满足下列条件的同分异构体有 种。
①含有一个苯环;②属于醇类且不能发生催化氧化反应;③核磁共振氢谱显示有5个峰
A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| A |
原子核外L层电子数是K层的2倍 |
| B |
其一种单质被称为地球生物的“保护伞” |
| C |
元素的第一电离能是第3周期所有元素中最小的 |
| D |
基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
| E |
可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
请回答下列问题:
(1)C在元素周期表中位于第 周期、第 族;D的基态原子核外电子排布式是 。
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同) ,B、D的简单氢化物中稳定性较大的是 。
(3)B的常见单质和C的单质按物质的量比1∶2反应生成的化合物中化学键的类型为 ;该化合物属于 晶体。
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是 。
(5)已知:2AB(g)+B2(g)=2AB2(g) ΔH="-566.0" kJ·mol-1,D(s)+B2(g)=DB2(g) ΔH="-296.0" kJ·mol-1,处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式: 。