铁及其化合物之间的相互转化可用下式表示:
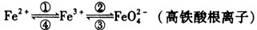
回答下列有关问题:
(1)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。
元素铁的原子结构示意图是 ;
(2)检验硫酸铁溶液中是否存在Fe2+的方法是 ;
(3)
(4)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+。Na2FeO4之所以能净水,除了能消毒杀菌外,另一个原因是(用离子方程式说明) 。
[化学—选修2:化学与技术]
将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓缩海水中通过一系列工艺流程提取其他产品。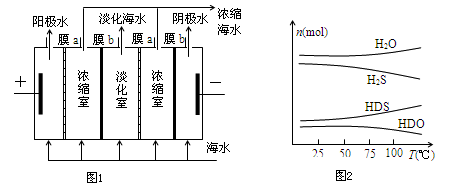
(1)如图1,用惰性电极在电场中利用膜技术(阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)淡化海水,该方法称为电渗析法。
①图1中膜a应选择_____________膜,阳极的电极反应式为_________________;
②电渗析法还可以用来处理电镀废液,写出用该方法处理含硫酸铜废液时(使用惰性电极)所发生的电极反应:阴极_________________阳极_________________;
(2)海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称。工业上是将氯气通入到含溴离子的浓缩海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴。该方法中反应的离子方程式依次为①Cl2+2Br-=Br2+2Cl-
②3Br2+3CO32-=BrO3-+5Br-+3CO2↑③_____________________________;产生1molBr2时,该反应转移的电子数为____________。
(3)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO.其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同温度下发生的两个不同反应得到较高浓度的HDO. 如图2为“硫化氢-水双温交换法”所发生的两个反应中涉及的四种物质在反应体系中的物质的量随温度的变化曲线.写出100℃时所发生的反应的化学方程式_________________________;工业上富集HDO的生产过程中,可以循环利用的一种物质是____________。
硫的化合物在科研、生活及化学工业中具有重要的应用。
(1)在废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。25℃,在0.10 mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发)。
| pH |
3 |
5 |
7 |
9 |
11 |
| c(S2-)/ mol•L-1 |
1.4×10-15 |
1.4×10-11 |
6.8×10-8 |
1.3×10-5 |
1.3×10-3 |
某溶液含0.020 mol•L-1Mn2+、0.1 mol•L-1H2S,当溶液的pH=5时,Mn2+开始沉淀,则MnS的溶度积=________________。
(2)工业上采用高温分解H2S制取氢气,其反应为2H2S(g) 2H2(g)+S2(g) △H1,在膜反应器中分离出H2。
2H2(g)+S2(g) △H1,在膜反应器中分离出H2。
①已知:H2S(g) H2(g)+S(g) △H2,2S(g)
H2(g)+S(g) △H2,2S(g) S2(g)△H3。则△H1=_______(用含△H2、△H3的式子表示。
S2(g)△H3。则△H1=_______(用含△H2、△H3的式子表示。
②在密闭容器中,充入0.10molH2S(g),发生反应2H2S(g) 2H2(g)+S2(g),控制不同的温度和压强进行实验。结果如图所示。
2H2(g)+S2(g),控制不同的温度和压强进行实验。结果如图所示。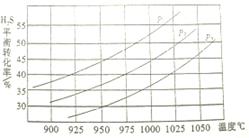
图中压强p1、p2、p3由大到小的顺序为_______________,理由是_________________。若容器的容积为2.0L,则压强为p3,温度为950℃时,反应经3h达到平衡,则达到平衡时v(S2)=__________;若压强p2=7.2MPa,温度为975℃时,该反应的平衡常数Kp=_____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),若保持压强不变,升温到1000℃时,则该反应的平衡常数___________(填“增大”“不变”或“减小”)。
(3)工业上用惰性电极电解KHSO4饱和溶液制取H2O2,示意图如图所示:
①低温电解饱和KHSO4溶液时阳极的电极反应式为_________________。
②K2S2O8水解时生成H2O2和KHSO4,该反应的化学方程式为_________________。
【化学—选修2:化学与技术】普通纸张的主要成分是纤维素。在早期的纸张生产中,常采用纸表面涂明矾的工艺,以填补其表面的微孔,防止墨迹扩散,请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存.经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是______________;为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为______________;
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等.这样操作产生的主要问题是______________;
②喷洒Zn(C2H5)2.Zn(C2H5)2可以与水反应生成氧化锌和乙烷.用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理______________;
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾.钛白粉的一种工业制法是以钛铁矿(主要成分为FeTiO3)为原料按下列过程进行的,请完成下列化学方程式:
①______ FeTiO3+____ C+___ Cl2 ____ TiCl4+___ FeCl3+____CO
____ TiCl4+___ FeCl3+____CO
②______ TiCl4+____ O2 ____ TiO2+____ Cl2。
____ TiO2+____ Cl2。
(15分)最近科学家提出“绿色自由”构想:把含有大量CO2的空气吹入碳酸钾溶液中,再把CO2从溶液中提取出来,并使之与氢气反应生成可再生能源甲醇。其工艺流程如图所示: 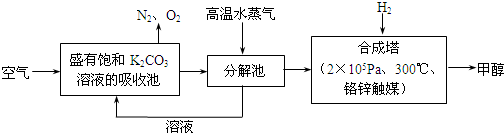
(1)写出分解池中反应的化学方程式为_______________;
(2)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出4947kJ的热量,试写出该反应的热化学方程式_______________;
(3)已知合成塔中的反应是可逆的,根据平衡移动原理,低温有利于原料气的转化,而实际生产中采用300℃的温度,其原因可能是_______________;
(4)“绿色自由”构想流程中常包括物质的“循环利用”,上述流程中能体现“循环利用”的物质除碳酸钾溶液外,还包括________(化学式)。
(5)300℃时,将CO和H2按1:3的体积比充入密闭容器中,CO2的平衡转化率(α)与体系总压强(p)的关系如图所示。根据图示回答下列问题: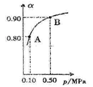
①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再达平衡是,与原平衡比较下列说法正确的是________。
| A.CO2的浓度减小 |
| B.正反应速率增大,逆反应速率减小 |
| C.CO2和H2的体积比为1:3 |
| D.CH3OH的体积分数增大 |
②将1.0molCO2和3.0molH2置于体积不变的密闭容器中,2min时反应达到平衡,此时体系总压强为0.10MPa,用H2表示的反应速率为1.2mol/(L·min),则密闭容器的体积是____L。
(6)甲醇可制作燃料电池。以氢氧化钾溶液为电解质的负极反应式是__________。当转移的电子的物质的量为_______mol时,参加反应的氧气的体积是6.72L(标准状况下)。
硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g) 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度 |
450 |
500 |
550 |
600 |
| SO2的转化率% |
97.5 |
95.8 |
90.50 |
80.0 |
(1)由表中数据判断△H 0(填“>”、“=”或“<”)
(2)能判断该反应是否达到平衡状态的是
A容器的压强不变 B混合气体的密度不变
C混合气体中SO3的浓度不变 D C(SO2)=C(SO3)
E V正(SO2)=V正(SO3) F V正(SO3)=2V逆(O2)
(3)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1.
①0~2min之间,O2的反应速率为 .
②此时的温度为 ℃.
③此温度下的平衡常数为 (可用分数表示).
(4)若将平衡反应混合物的压强增大(假如体积可变),平衡将 向移动.