A~G是几种烃的分子球棍模型(如图),据此回答下列问题: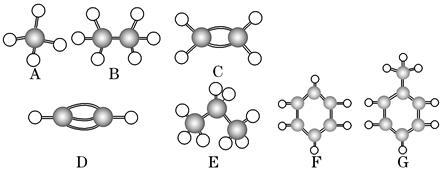
(1)常温下含碳量最高的气态烃是________(填字母)。
(2)不能够发生加成的烃有________种。
(3)一卤代物有两种的是________(填字母)。
(4)等质量的上述烃燃烧耗氧最多的是________(填字母)。
(5)写出实验室制C的化学方程式_______________。
(6)写出F发生溴代反应的化学方程式____________。
[化学—选修5:有机化学基础](15分)脱水偶联反应是一种新型的直接烷基化反应,例如,反应①:
(1)化合物Ⅰ中含有的官能团的名称为_______,1 mol该物质完全水解最少需要消耗_______mol NaOH。
(2)化合物Ⅱ可使________溶液(限写一种)褪色;化合物Ⅲ(分子式为C10H11Cl)可与NaOH水溶液共热生成化合物Ⅱ,相应的反应类型为________。
(3)化合物Ⅲ与NaOH乙醇溶液共热生成化合物Ⅳ,Ⅳ的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为1∶1∶1∶2,Ⅳ的结构简式为________。
(4)化合物Ⅴ是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物Ⅵ。Ⅵ的结构简式为________。检验Ⅵ中所含官能团,按使用的先后顺序写出所用试剂_________________________________。
(5)一定条件下, 与
与 也可以发生类似反应①的反应,有机产物的结构简式为______________________________________。
也可以发生类似反应①的反应,有机产物的结构简式为______________________________________。
【化学—选修3物质结构与性质】已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族。E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 。
(2)E2+离子的价层电子排布图是 ,F原子的电子排布式是 。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的VSEPR模型为 。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为 。
(6)某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d= g/cm3(保留两位小数)。
[化学一选修2:化学与技术](15分)硫酸是无机“三大强酸”之一,是工业生产中最为重要的产品之一,其产量是衡量一个国家无机化工发展水平的重要标志。在化学工业的很多领域都要用到浓硫酸。
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为______,该反应在____(填设备名称)中进行。
(2)有关接触法制硫酸的下列说法中,正确的是____。
| A.二氧化硫的接触氧化在合成塔中发生 |
| B.吸收塔得到的是98. 3%的浓硫酸 |
| C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2% |
| D.接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率 |
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图: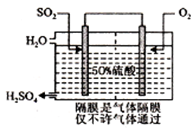
为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为____。
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是____。
(5)硫酸工厂排放的尾气中,含少量二氧化硫。为防止污染大气,在排放前必须进行尾气处理并设法进行综合利用。硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理。
①请写出这种尾气处理方法的优点(写出两点即可):
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上需生石灰____kg。
火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g) + 4NO2(g)=4NO(g) + CO2(g) + 2H2O(g)△H1=-574 kJ·mol-1
CH4(g) + 4NO(g)=2N2(g) + CO2(g) + 2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为 mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动。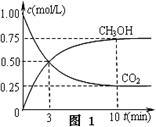
②取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇的反应的△H3 0(填“>”、“<”或“=”)。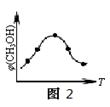
(3)脱硫。利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得。NaOH溶液吸收SO2的过程中,pH随n(SO32-)︰n(HSO3﹣)变化关系如下表:
| n(SO32﹣)︰n(HSO3﹣) |
91︰9 |
1︰1 |
9︰91 |
| pH |
8.2 |
7.2 |
6.2 |
①由上表判断,NaHSO3溶液显 性,用化学平衡原理解释: 。
②当溶液呈中性时,离子浓度关系正确的是(选填字母) 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+) > c(HSO3-) > c(SO32-) > c(H+) = c(OH-)
c.c(Na+) + c(H+) = c(SO32-) + c(HSO3-) + c(OH-)
(12分)【选做题】本题包括A, B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.〔物质结构与性质〕我国部分城市灰霾天占全年一半,引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3,有机颗粒物及扬尘等。通过测定灰霾中锌、铬等重金属的含量,可知目前造成我国灰霾天气主要是交通污染。
(1)Cr在基态时核外电子排布式为_____
(2)NH4+的空间构型是_____(用文字描述)。
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOX、O3、CH2=CH-CHO,HCOOH,CH3COOONO2(PAN)等二次污染物。
①写出与N2O等电子体的一种分子的化学式_____。
②1mol CH2=CH-CHO中含σ键数目为_____。
③NO能被FeS04溶液吸收生成配合物[(Fe(NO)(H20)5]S04,该配合物中心离子的配位数为_____(填数字)。
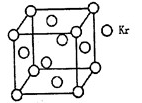
(4)测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n=_____(填数字)。