(10分)(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
| 烯类化合物 |
相对速率 |
| (CH3)2C==CHCH3 |
10.4 |
| CH3CH==CH2 |
2.03 |
| CH2="=" CH2 |
10.0 |
| CH2==CHBr |
0.04 |
据表中数据,总结烯类化合物加溴时,反应速率与C==C上取代基的种类、个数间的关系:____________________________________。
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是_________。
| A.(CH3)2C==C(CH3)2 |
| B.CH3CH==CHCH3 |
| C.CH2="=" CH2 |
| D.CH2==CHCI |
、氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为(用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为  。
。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续
不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ. 2Li + H2 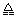 2LiHⅡ. LiH + H2O ="=" LiOH + H2↑
2LiHⅡ. LiH + H2O ="=" LiOH + H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度约为0.8g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
2SO2(g)+ O2(g) 2SO3(g)△H =" a" kJ·mol-1,反应过程的能量变化如图所示。
2SO3(g)△H =" a" kJ·mol-1,反应过程的能量变化如图所示。
已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
⑴图中A点表示_________________,a=__________。
⑵Ea的大小对该反应的△ H _______(填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点___________(填“升高”、“降低”或“不变”)。
H _______(填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点___________(填“升高”、“降低”或“不变”)。
⑶已知单质硫的燃烧热为296kJ·mol-1,写出反应的热化学方程式:____,常温常压下,由单质硫和氧气经两步反应,生成3 mol SO3(g),放出的总热量为____。
将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C(s) + H2O(g)=CO(g) + H2(g);△H1。已知:
①2H2(g) + O2(g) = 2H2O(g);△H2=-483.6kJ·mol-1
②2C(s) + O2(g) = 2 CO(g);△H3=-221.0kJ·mol-1
结合上述热化学方程式,计算得出△H1=。
下列各情况,在其中Fe片腐蚀由快到慢的顺序是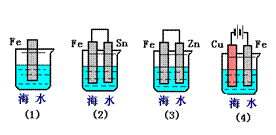
下图中A、B均为固体,其中B为单质。下图可用于工业生产F,F是衡量一个国家化工水平的标志。回答下列问题:
(1)A的化学式
(2)反应①是一个氧化还原反应,该反应发生时,每生成4 mol气体C,
转移电子mol
(3)写出D与铝单质反应的化学方程式
(4)反应②是可逆反应,在2 L的密闭容器中投入 4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是
4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是
A.工业制取F时,C和X生成E的反应是在吸收塔进行
B.这10分钟内,X的平均速率是0.1mol/( L·min)
C.当C和X的消耗速率比为2:1时,标志着反应达到平衡
D.平衡时C的转化率是50%
E.在工业生产中可以通过增加X的量来 提高C的转化率
提高C的转化率
F.工业生产中直接用水来吸收E
(5)写出2.24L气体C与0.15mol氢氧化钠溶液反应的离子化学方程式
(6)将5 mL 0.02mol/L的F溶液与5 mL 0.02 mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是写出F的一种用途