(15分)能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化如下:
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
(3)某化学兴趣小组构想将NO转化为HNO3,装置如下图,电极为多孔惰性材料。则负极的电极反应式是 。
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________(填“>”、“<”或“=”)0。
(5)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
(8分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: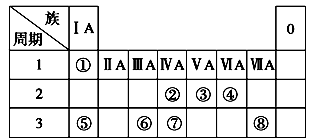
(1)画出⑧原子结构示意图__________ __;
(2)④、⑤、⑥的简单离子半径由大到小的顺序是________。(用离子符号表示)
(3)①-⑧的元素中,某元素气态氢化物与其最高价氧化物对应的水化物反应所得生成物溶于水,溶液呈酸性,原因是____ _ _(用离子方程式表示),该氢化物分子空间结构为______ _;
(4)写出由元素⑥组成的单质与元素⑤最高价氧化物对应的水化物的水溶液反应的离子方程式_。
X、Y、T、Q 四种元素,位于元素周期表前四周期,元素的性质或结构信息见下表。
| 元素 |
性质或结构信息 |
| X |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
| Y |
二价阳离子的外围电子层排布为3d9 |
| T |
原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
| Q |
第三周期主族元素中原子半径最小。 |
请根据上述信息回答下列问题:
(1)写出 X3- 的一种等电子体的化学式;X的气态氢化物易液化的原因:。
(2)写出T元素基态原子的核外电子排布图;Q元素的原子核外有种运动状态不同的电子。
(3)元素 X 、T 的电负性相比,的小(填元素名称);元素 X 的第一电离能与T相比较,T的(填“大”或“小”)。
(4)甲醛(CH2O)分子中σ 键与π 键的个数之比为。
(5)Y元素在周期表中位于区。Y单质晶体的晶胞如图所示,该晶胞中实际拥有个原子,该晶体中Y原子在三维空间里的堆积方式为堆积。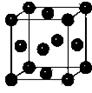
(6)在Y的硫酸盐溶液中通入X的气态氢化物至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。此蓝色沉淀溶解的离子方程式为:。
(7)元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为:,分子中X原子的杂化方式为杂化。
A、B、C、D、E、F是原子序数依次增大的同周期元素,已知A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水;D元素原子的次外层电子数比最外层电子数多4,E元素原子的最外层与最内层电子数的差是3。试回答下列问题:
(1)写出下列元素符号:A,C,D,E。
(2)用电子式表示B和F形成化合物的过程:。
(3)写出A、C、F三种元素最高价氧化物对应的水化物相互反应的化学方程式:
、、。
(10分)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:A:__________;B:__________;C:__________;D:_______。
(2)写出A、B、E三种微粒反应的离子方程式:__________________。
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。回答下列问题:
(1)①A与E形成的化合物的化学式是。
②B的最高价氧化物化学式为。
③C的元素名称为。
(2)D的单质与水反应的方程式为:。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是,有关反应的离子方程式为:,。