H2和I2在一定条件下能发生反应:H2(g)+I2(g) 2HI(g) △H=-a kJ/mol.已知:
2HI(g) △H=-a kJ/mol.已知: (a、b、c均大于零)。
(a、b、c均大于零)。
下列说法正确的是
| A.H2、I2和HI分子中的化学键都是非极性共价键 |
| B.断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ |
| C.相同条件下,1 mol H2 (g)和1mol I2 (g)总能量小于2 mol HI (g)的总能量 |
| D.向密闭容器中加入2 mol H2 (g)和2 mol I2 (g),充分反应后放出的热量为2a kJ |
下列说法不正确的是()
| A.能够发生有效碰撞的分子叫做活化分子 |
| B.升高温度,活化分子百分数增大,化学反应速率增大 |
| C.加入反应物,活化分子百分数增大.化学反应速率增大 |
| D.使用催化剂,活化分子百分数增大,化学反应速率增大 |
下列物质的水溶液能导电,但属于非电解质的是()
| A.CH3COOH | B.Cl2 | C.NH4HCO3 | D.SO2 |
下列说法中不正确的是
| A.煤、石油、天然气均为化石能源 |
| B.化石燃料在燃烧过程中能产生污染环境的SO2等有害气体 |
| C.直接燃烧煤不如将煤进行深加工后再燃烧效果好 |
| D.化石能源是可再生能源 |
下列离子方程式正确的是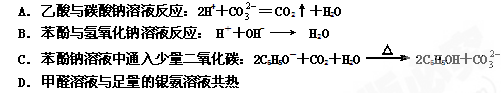
如图,某高分子材料是由三种单体聚合而成的,以下与此高分子材料相关的说法正确的是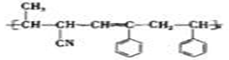
A.该高分子材料属于纯净物,合成它的反应是加聚反应