同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H=-92.6kJ/mol.测得数据如表
2NH3(g) △H=-92.6kJ/mol.测得数据如表
| 容器编号 |
起始时各物质物质的量/mol |
达到平衡时体系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| (1) |
2 |
3 |
0 |
27.78kJ |
| (2) |
1.6 |
1.8 |
0.8 |
Q |
下列叙述不正确的是( )
A.容器(1)(2)反应达平衡时压强相等
B.容器(2)中反应开始时v(正)>v(逆)
C.容器(2)中反应达平衡时,吸收的热量Q为9.26kJ
D.若条件为“绝热恒容”,容器(1)中反应达平衡时n(NH3)<0.6mol
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )。
A.1 L 0.1 mol·L-1(NH4)2Fe(SO4)2·6H2O的溶液中:c(NH4+)+c(Fe2+)+c(H+)=c(OH-)+c(SO42-)
B.0.1 mol·L-1 NH4HS溶液中:c(NH4+)<c(HS-)+c(H2S)+c(S2-)
C.0.1 mol·L-1 pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-)
D.等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:2c(OH-)+c(CO32-)=c(HCO3-)+3c(H2CO3)+2c(H+)
室温时,向20 mL 0.1 mol·L-1醋酸溶液中不断滴入0.1 mol·L-1 NaOH溶液,溶液的pH变化曲线如下图所示。在滴定过程中,下列关于溶液中离子浓度大小关系的描述,不正确的是( )。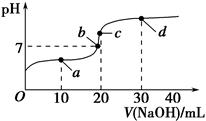
| A.a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.b点时:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
| C.c点时:c(H+)=c(CH3COOH)+c(OH-) |
| D.d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
某碱性溶液中只含有Na+、CH3COO-、H+、OH- 4种离子。下列描述正确的是( )。
| A.该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| B.该溶液一定由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成 |
| C.该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.加入一定量冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+) |
用水稀释0.1 mol·L-1氨水时,溶液中随水量的增加而减小的是( )。
| A.c(OH-)/c(NH3·H2O) |
| B.c(NH3·H2O)/c(OH-) |
| C.n(OH-)和c(H+) |
| D.c(H+)和c(OH-)的乘积 |
部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡 常数(25℃) |
Ki=1.77×10-4 |
Ki=4.9×10-10 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项正确的是( )。
A.2CN-+H2O+CO2=2HCN+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.等浓度的HCOONa和NaCN溶液的pH前者大于后者
D.中和等浓度的HCOOH和HCN消耗NaOH的量前者等于后者