下列离子方程式或化学方程式与所述事实相符且正确的是
| A.向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液:H++OH- = H2O |
B.以金属银为阳极电解饱和NaCl溶液:2Cl-+2H2O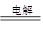 H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
| C.硫酸与氢氧化钡反应的中和热化学反应方程式为:1/2 H2SO4(aq)+1/2 Ba(OH)2(aq) =" 1/2" BaSO4(s)+H2O(l)ΔH=-57.3 kJ/mol |
| D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-= AlO2-+2BaSO4↓+2H2O |
向酸化过的MnSO4溶液中滴加(NH4)2S2O8(过二硫酸铵)溶液会发生反应:Mn2++S2O82—+H2O―→MnO4—+SO42—+H+。下列说法不正确的是 ( )。
| A.可以利用该反应检验Mn2+ |
| B.氧化性比较:S2O82—>MnO4— |
| C.MnSO4溶液可以使用盐酸酸化 |
| D.若有0.1 mol氧化产物生成,则转移电子0.5 mol |
下列离子方程式书写正确的是 ( )。
| A.Fe3O4溶于足量稀HNO3:3Fe3O4+28H++NO3—=9Fe3++NO↑+14H2O |
| B.用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+=Ca2++CO2↑+H2O |
| C.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2=2Fe3++2H2O |
D.电解MgCl2水溶液的离子方程式:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
向等物质的量浓度的NaHCO3和Ca(HCO3)2的混合溶液中,加入一定量NaOH溶液时,不可能发生的离子反应方程式是 ( )。
| A.OH-+HCO3—=CO32—+H2O |
| B.Ca2++OH-+HCO3—=CaCO3↓+H2O |
| C.Ca2++2OH-+2HCO3—=CaCO3↓+2H2O+CO32— |
| D.Ca2++3OH-+3HCO3—=CaCO3↓+3H2O+2CO32— |
下列反应对应的离子方程式书写正确的是 ( )。
| A.漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO3— |
| B.氢氧化钡溶液与硫酸氢钠溶液反应后溶液恰好为中性:Ba2++H++SO42—+ OH-=BaSO4↓+H2O |
| C.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| D.在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4,4OH-+3ClO-+ |
2Fe(OH)3=2FeO42—+3Cl-+5H2O
下列离子方程式书写正确的是 ( )。
| A.澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3—=CaCO3↓+CO32—+2H2O |
| B.磁性氧化铁置于氢碘酸溶液中:Fe3O4+8HI=2Fe3++Fe2++4H2O+8I- |
| C.NaHSO4溶液中滴加过量Ba(OH)2溶液:H++SO42—+Ba2++OH-=BaSO4↓+H2O |
| D.醋酸与氨水混合:CH3COOH+NH3·H2O=CH3COONH4+H2O |