(13分)钠的化合物在日常生活中应用广泛.
(1)碳酸氢钠是发酵粉的成分之一,其俗称是 .
(2)氯化钠是重要的调味品,通过以下化学反应均能生成NaCl.
反应一:钠在氯气中燃烧.反应的化学方程式为 .
反应二:NaOH溶液与稀盐酸反应.关于该反应,下列说法正确的是
| A.该反应是中和反应 |
| B.将一定量的稀盐酸逐滴滴入NaOH溶液中,pH不断减小,说明两者发生了反应 |
| C.将一定量的稀盐酸滴入滴有酚酞的NaOH溶液中,溶液仍为红色,说明两者不反应 |
| D.将一定量的稀盐酸与NaOH溶液混合后溶液的pH=7,说明两者发生了反应 |
E.将NaOH固体放入稀盐酸中,放出热量,说明两者发生了反应
反应三:用Na2CO3溶液和稀盐酸混合.反应的化学方程式为: .
充分反应后的溶液中一定有NaCl,可能有Na2CO3或盐酸.
①为确定反应后溶液中的溶质,同学们进行了如下实验:
步骤I、确定溶液中是否含有盐酸:
甲同学选用了酸碱指示剂中的 试液;
乙同学选用了镁粉,通过实验观察到 ,确定溶液中一定没有盐酸.
步骤II、通过实验确定溶液中含有Na2CO3
②欲从反应后溶液中得到纯净的NaCl,丙同学设计了如下实验方案:
| 方案 |
加入试剂 |
分离方法 |
方案评价 |
| 一 |
适量Ba(OH)2溶液 |
过滤、蒸发结晶 |
不可行,理由是: |
| 二 |
适量的 |
|
可行 |
(3)(4分)过氧化钠(Na2O2)是供氧设备中常用的供氧剂.韩国“岁月号”沉船事故发生后,
几百名潜水员携带水下供氧设备参与了打捞工作.过氧化钠与水的反应为:2Na2O2+2H2O═4NaOH+O2↑.现将15.6g过氧化钠加入盛有147.6g水(过量)的烧杯中充分反应,直至固体完全消失,不再有气泡产生.
请计算:①反应生成的氧气质量;②反应后所得溶液中溶质的质量分数.(写出计算过程)
酚酞是初中化学实验中常用到的酸碱指示剂,查资料可知酚酞的化学式为C20H14O4,请回答下列问题:
(1)酚酞中C、H、O元素的质量比为。
(2)一瓶60g质量分数为12%的酚酞试液中含酚酞的质量为g。
(3)取8g酚酞配成10%的溶液,需加水质量为g。
质量守恒定律是重要的三大定律之一,应用它可以帮助我们解决许多生产、科学实验和生活上的问题。现有氯酸钾和二氧化锰的混合物共26.5 g,加热使之反应,待反应至不再有气体生成后,将试管冷却、称量,得到剩余固体16.9g.求:
(1)制取氧气的质量共为___________ g。;
(2)原混合物中氯酸钾多少克?(写出解题过程)
右图为钙尔奇钙片商品标签图,请根据标签的有关信息完成下列各题。
(1)主要成分碳酸钙(CaCO3)由___________种元素组成。
(2)碳酸钙中各元素的质量比为___________________________________________。
(3)每片钙片中至少含钙元素的质量为__________________。
(6分) 铝箔容易与空气中氧气反应生成致密的氧化铝薄膜。某兴趣小组在烧杯中加入一定量已在空气中久置的铝箔,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如图所示。请回答下列问题:
(1)产生氢气g,
(2)计算所滴加的稀硫酸中溶质的质量分数。
课外化学兴趣小组的同学利用某化工厂的废碱液(主要成分为Na2CO3、还含有少量NaCl,其它杂质不计)和石灰乳(氢氧化钙的悬浊液)为原料制备烧碱,并对所得的烧碱粗产品的成分进行分析和测定。
【粗产品制备】
(1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰乳混合,发生反应的化学方程式为。
(2)将反应后的混合物过滤,得到的滤液进行蒸发结晶,制得NaOH粗产品。
【粗产品成分分析】
(1)取适量粗产品溶于水,加入Ba(NO3)2溶液出现白色浑浊,该反应的化学方程式为,由此该粗产品中一定不含有。
(2)该小组同学通过对粗产品成分的实验分析,确定该粗产品中含有三种物质。
【含量测定】Na2CO3含量的测定
(1)该兴趣小组的同学设计了下图所示的实验装置。取20.0g粗产品,进行实验。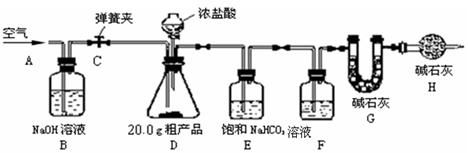
【说明】①碱石灰是CaO与NaOH的固体混合物。
②CO2在饱和NaHCO3溶液中的溶解度非常小。
(2)操作步骤:
①连接好装置,检查气密性;将药品加入各装置
②打开弹簧夹C,在A处缓缓通入一段时间空气;
③称量G的质量;
④关闭弹簧夹C,慢慢滴加浓盐酸,直至D中无气泡冒出;
⑤打开弹簧夹C,再次缓缓通入一段时间空气;
⑥再次称量G的质量,得前后两次质量差为0.48g。
(3)问题探究:
①在用托盘天平称量粗产品时,如果天平的指针向右偏转,说明。
②B装置的作用是。
③在步骤②中,A处缓缓通入一段时间空气的目的是。
④若没有H装置,则测定的Na2CO3的质量分数会(填“偏大”、“偏小”、“不变”)。
⑤该兴趣小组指导老师认为该方案有些不合理,指导同学们更换了其中的一种试剂并去掉了一个装置后实验得到了完善,并测得20.0 g粗产品只能产生0.44 g CO2。你认为更换后的试剂是,原实验中实验值0.48g比正确值0.44 g偏大的原因是(假设操作均正确)。(4)数据计算:
根据正确值0.44 g,求得粗产品中Na2CO3的质量分数是(写出计算过程)。