某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2)。该小组同学进行如下探究。
探究一:该气体的成分。
【猜想与假设】小华说:该气体可能是CO2、O2、CO、H2、N2。
小明说:不可能含有N2,因为_________________________。
小芳说:不可能含有CO和H2,因为从药品安全角度考虑,H2易燃易爆,CO有毒。
该小组同学认为:该气体可能含有CO2、O2中的一种或两种。
【进行实验】
| 实验编号 |
实验操作 |
实验现象 |
| ① |
将气体通入澄清的石灰水中 |
澄清石灰水变浑浊 |
| ② |
将带火星的木条伸入该气体中 |
带火星的木条没有复燃 |
【得出结论】(1)由实验①可知,该气体中肯定含有_________,写出该反应的化学方程式_____________________________________________________。
(2)由实验② (填“能”或“不能”)确定该气体中不含氧气。
探究二:维C泡腾片溶液的酸碱性。
向维C泡腾片溶液中滴加石蕊试液,溶液变红,说明溶液显 性。
某化学兴趣小组的同学用洁净的塑料瓶从河中取回一定量的水样,然后进行如下研究分析: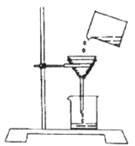
(1)将浑浊的河水样品倒入烧杯中,加入明矾粉末(吸附杂质,使杂质沉降)搅拌,静置一会儿;
(2)将静置后的河水采用如图所示的装置进行过滤,请问:图中还缺少的一种仪器是_____________,其作用是____________________________。
图中实验装置还存在的两处错误是:
_____________________________,____________________________。
(3)某同学用如图的装置进行过滤操作,实验后发现滤液仍浑浊,请你写出可能的两点原因:
①_____________________________________________;
②_____________________________________________。
通常状况下,酒精是一种无色液体,有特殊的醇香味,具有可燃性。它是由哪些元素组成的呢?小明同学进行了如下探究活动。
【作出假设】酒精中可能含有碳、氢、氧元素。
【收集证据】按下图所示装置进行实验,观察到漏斗壁上有水珠出现,试管内的澄清石灰水变浑浊了。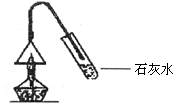
【得出结论】(1)根据上述实验现象你得出的结论是:_______________________________
_________________________,依据是____________________________________________。
(2)有人说该实验不能确定酒精中是否一定含有氧元素。对此,你认为这种看法是________的,理由是:________________________________________________________。
(每空2分,共12分)化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
[提出问题1] 该氢氧化钠溶液是否变质了呢?
[实验探究1]
| 实验操作 |
实验现象 |
实验结论 |
| 取少量该溶液于试管中,向溶液中滴加稀盐酸,并不断振荡。 |
有气泡冒出。 |
氢氧化钠溶液一定变质了。 |
[提出问题2] 该氢氧化钠溶液是全部变质还是部分变质呢?
[猜想与假设]
猜想1:氢氧化钠溶液部分变质。
猜想2:氢氧化钠溶液全部变质。
[查阅资料] (1)氯化钙溶液呈中性。
(2)氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl
[实验探究2]
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡。 |
有生成。 |
明原溶液中一定有碳酸钠。 |
(2)取步骤(1)试管中的少 量上层清液,滴加酚酞溶液。 量上层清液,滴加酚酞溶液。 |
溶液变红色。 |
说明原溶液中一定有。 |
[实验结论] 该氢氧化钠溶液(填“部分”或“全部”)变质。
[反思与评价] (1)氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式:。
(2)在上述[实验探究2]中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案
(填“可行”或“不可行”)。
[理解与应用]氢氧化钠溶液容易变质,必须密封保存。实验室必须密封保存的药品还有很多,试另举一例:
草酸亚铁晶体(化学组成为FeC2O4·xH2O)是一种淡黄色晶体粉末,常用于照相显影剂及制药工业,是电池材料的制备原料.
5、铁的氧化物被CO还原所需的温度:
草酸亚铁晶体受热分解可以生成四种氧化物,为确定分解后的产物及x的值,某实验小组设计了如下实验装置并进行探究(酒精灯略去,不考虑装置中气体的质量,且无水CuSO4足量):
【实验步骤】:
①连接好装置, ▲;
②称量装置B(含两侧弹簧夹)、C的质量;
③在热分解装置中装入一定质量的草酸亚铁晶体,打开弹簧夹a、b,鼓入一段时间氮气;
④ ▲,用酒精灯加热热分解装置,直至晶体完全变成黑色,停止加热;
⑤打开弹簧夹a,继续通氮气至装置冷却,关闭弹簧夹a、b;
⑥再次称量装置B、C的质量.
【进行实验】:该小组同学按上述实验步骤进行实验,并记录了如下数据:
| 装置B的质量(/g) |
装置C的质量(/g) |
|
| 实验前 |
145.8 |
168.2 |
| 实验后 |
140.4 |
170.0 |
| 热分解装置质量为136.8g |
【实验分析及数据处理】:
(1)实验过程中,装置C中固体颜色变为蓝色,说明草酸亚铁晶体分解生成了 ▲,FeC2O4·xH2O中x的值为 ▲;
(2)装置E出现黑色物质,说明草酸亚铁晶体分解生成了 ▲;
(3)装置C中澄清石灰水变浑浊,说明草酸亚铁晶体分解生成了 ▲;
(4)根据上表数据,计算反应后,热解装置中残留黑色物质的化学式;
(提示:相对分子质量分别为FeC2O4:144; H2O:18) ▲;
(5)实验过程中,鼓入氮气的目的是 ▲;
(6)实验后,热解装置中固体的颜色由淡黄色变成黑色,写出草酸亚铁晶体受热分解的化学方程式 ▲;
【反思应用】:
(7)有同学认为,实验中生成的CO和铁的氧化物会继续反应生成铁。你认为这种说法是否正确?请说出可能的理由 ▲;
(8)经过讨论,同学们一致认为上述实验装置有不足,你认为是什么? ▲;
(9)某些食品的包装袋中,常用氧化亚铁作为防伪试剂,一旦包装打开,立即变成红棕色,写出该反应的化学方程式 ▲.
酒精灯是实验室中常用的加热仪器,某小组同学对酒精灯火焰温度进行如下探究。
(Ⅰ)定性研究:甲同学取一根火柴梗。拿住一端迅速平放入酒精灯火焰中,1~2s后取出,观察到位于外焰的部分明显碳化。
(1)由上述现象得出结论:外焰温度最高。你认为原因是_______________________。
(Ⅱ)定量研究:乙和丙同学在老师指导下,分别利用高温传感器测得酒精灯各层火焰平均温度如下表。
| 火焰层 |
平均温度/℃ |
|
| 乙 |
丙 |
|
| 焰心 |
432 |
598 |
| 内焰 |
666 |
783 |
| 外焰 |
520 |
667 |
(2)由上表得出结论:___________(填“焰心”、“内焰”或“外焰”)温度最高。
(3)结合定量研究结论,下列图示中加热方法(试管夹未画出)最合理的是_____(填字母)
(Ⅲ)交流反思:不仅酒精灯的各层火焰温度不同,而且相同火焰层温度也有差异。
(4)造成乙、丙两同学所测相同火焰层温度差异的原因可能是(写出两点即可)
①_______________________;②__________________________。