实现下列操作的正确方法依次是
①分离植物油和水 ②去除KNO3溶液中少量的NaCl杂质 ③以海水为原料制取粗盐
| A.蒸发、萃取、分液 | B.萃取、过滤、结晶 |
| C.过滤、蒸发、萃取 | D.分液、结晶、蒸发 |
下列实验误差分析错误的是()
| A.用湿润的pH试纸测稀碱液的pH,测定值偏小 |
| B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| D.测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小 |
Al、Fe、Cu都是重要的金属元素。下列说法正确的是( )
| A.三者对应的氧化物均为碱性氧化物 |
| B.三者的单质放置在空气中均只生成氧化物 |
| C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| D.电解AlCl3、FeCl3、CuCl2的混合溶液是阴极上依次析出Cu、Fe、Al |
下列各组离子在指定溶液中一定能大量共存的是()
| A.在能使石蕊试纸变蓝色的溶液中:Na+、AlO2-、S2-、SO42- |
B.由水电离出的c(H+)=10-12mol·L-1的溶液中:Cl-、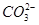 、NH4+、SO32 、NH4+、SO32 |
C.在加入铝粉能产生H2的溶液中:NH4+、Na+、Fe2+、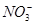 |
| D.pH=2的溶液中:Na+、SO42-、ClO-、SO32 |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3Sn2++2H3AsO3+6H++18Cl-==2As+3SnCl62-+6M。关于该反应的说法中正确的组合是()
①氧化剂是H3AsO3
②还原性:Cl->As
③每生成1 mol As,反应中转移电子的物质的量为3 mol
④M为OH-⑤SnCl62-是氧化产物
| A.①②④⑤ | B.①③⑤ |
| C.①②③④ | D.只有①③ |
运用有关概念判断下列叙述正确的是()
| A.1molH2燃烧放出的热量为H2的燃烧热 |
| B.Na2SO3和H2O2的反应为氧化还原反应 |
C. 和 和 互为同系物 互为同系物 |
| D.BaSO4的水溶液不导电,故BaSO4是弱电解质 |