有①Cu-Zn ②Cu-Ag两种貌似黄金的合金,它们都有其特殊的用途,但一些骗子常用它们做成饰品冒充真黄金欺骗消费者.对此,化学科学有责任加以揭露.
(1)现有上述两种合金制成的假黄金饰品各一件,小明同学只用稀盐酸和必要的实验仪器就鉴别出其中一种饰品是假黄金,它是合金 (填写代号);若要证明另一种饰品也是假黄金,可选用一种盐溶液来验证,这种盐可以是 (写一种盐的名称或化学式);
(2)取与上述用稀盐酸鉴别出的同种合金10g,放入烧杯中,再向其中加入93.7g某稀盐酸恰好完全反应后,测得烧杯内剩余物质的质量共为103.5g.
①上述过程中变化的质量10g + 93.7g -103.5g =0.2g是 (填物质的名称或化学式)的质量;
②10 g该合金中铜的质量是多少?已知反应后的溶液中溶质全部溶解,求该溶液中溶质的质量分数是多少?
铜镁合金具有优良的导电性,常用作飞机天线等导电材料.欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金20g放入烧杯,将280g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下.请计算:
| 次数 |
1 |
2 |
3 |
4 |
| 加入稀硫酸质量/g |
70 |
70 |
70 |
70 |
| 剩余固体质量/g |
18.2 |
16.4 |
14.6 |
13.2 |
(1)合金中铜、镁的质量比.
(2)所加稀硫酸的溶质的质量分数.(写出计算过程)
(重庆)工业上采用离子交换膜电解槽电解饱和食盐水,可以得到高浓度的烧碱溶液(含NaOH35%~48%).某学习小组为了验证附近氯碱化工厂产生的NaOH溶液是否达到高浓度标准,进行了如下操作,请你参与计算:
(1)到工厂采集了电解槽中的NaOH溶液100g.NaOH中氧元素的质量分数是________.
(2)在实验室用如图所示浓硫酸配制200g 24.5%的稀硫酸,计算所取浓硫酸的体积(计算结果取整数).
(3)进行中和测定,向采集到的溶液中逐渐加入所配制的稀硫酸,并不断测定溶液的pH,当pH=7时,消耗稀硫酸160g.通过计算判断此时电解槽中NaOH溶液是否达到高浓度标准.
20℃时,硝酸钾的溶解度为31.6g,将20g硝酸钾投进50g水中,充分搅拌,制成20℃时的溶液,求该溶液中溶质的质量分数.
把10g铁和铜的混合物放到盛有足量盐酸的烧杯中,充分反应后,烧杯中物质的总质量比反应前(铁、铜混合物和盐酸)减少了0.2g,求原混合物中铜的质量分数.
为测定某赤铁矿石中氧化铁的质量分数,小龙和他的同学用足量的纯净的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图所示.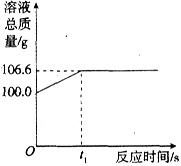
(1)上述反应产生二氧化碳的质量为________g.
(2)计算该赤铁矿石中氧化铁的质量分数.
(3)若上述反应后剩余固体的质量为mg,写出计算该赤铁矿石中氧化铁质量分数的表达式:________________________(用m表示).