某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是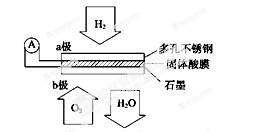
| A.电子通过外电路从b极流向a极 |
| B.b极上的电极反应式为O2+2H2O+4e-===4OH- |
| C.每转移0.2 mol电子,消耗标准状况下1.12 L的H2 |
| D.H+由a极通过固体酸电解质传递到b极 |
已知室温下,Al(OH)3的溶解度远大于Fe(OH)3。向浓度均为0.1mol·L—1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是
在一种酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种离子,向溶液中加入溴水,溴单质被还原,由此可推断溶液中
| A.一定含有I-,不能含有Cl- | B.可能含有Cl-、NO3-和I- |
| C.可能含有NO3- | D.不含有Fe3+ |
下列各组离子能在指定环境中大量共存的是
| A.在c(HCO3-)=0.1 mol·L-1的溶液中:NH4+、Al3+、Cl-、NO3- |
| B.在由水电离出的c(H+)=1×10-12mol·L-1的溶液中:Fe2+、ClO-、Na+、SO42- |
| C.在加入镁粉产生气体的溶液中:SO42-、NO3-、Na+、Fe2+ |
| D.在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ |
一定量的镁溶于一定浓度的硝酸的反应中,产生标准状况下的N2O气体11.2L,在所得的溶液中加入足量的氢氧化钠溶液,完全反应后过滤出沉淀,经洗涤、蒸干并充分灼烧,最后得到固体的质量为
| A.20g | B.40g | C.58g | D.80g |
下列说法中正确的是
| A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L |
| B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L |
| C.配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾 |
| D.中和100 mL 1 mol/L的H2SO4溶液,需NaOH 4 g |