下列实验操作或所记录的数据合理的是
| A.NaOH溶液可保存在玻璃塞的试剂瓶中 |
| B.一学生用pH试纸测得某氯水的pH为2 |
| C.液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 |
| D.配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
设NA表示阿伏加德罗常数,下列有关说法正确的是
| A.1.0 L 1 mol/L的NaNO3溶液中含有的氧原子数为3NA |
| B.30 g SiO2晶体中含有Si-O键数目为2NA |
| C.25℃时,pH=12的NaOH溶液中含有OH-的数目为0.01NA |
| D.1mol羟基与1molOH-离子所含电子数均为10NA |
用下列实验装置进行相应实验,能达到实验目的的是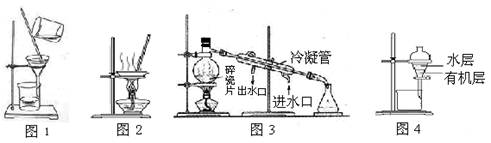
| A.用图1 所示装置除去Fe(OH)3胶体中含有的少量FeCl3杂质 |
| B.用图2 所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C.用图3 所示装置从海水制取蒸馏水 |
| D.用图4 所示装置分离酒精萃取碘水中的碘 |
下列关于物质分类的正确组合是
| 碱 |
酸 |
盐 |
碱性氧化物 |
酸性氧化物 |
|
| A |
纯碱 |
盐酸 |
烧碱 |
氧化铝 |
二氧化硫 |
| B |
烧碱 |
硫酸 |
食盐 |
氧化铁 |
二氧化氮 |
| C |
苛性钾 |
硬脂酸 |
小苏打 |
氧化钙 |
五氧化二磷 |
| D |
苛性钠 |
石炭酸 |
硫酸铵 |
过氧化钠 |
二氧化硅 |
化学与生活密切相关,下列说法不正确的是
| A.“地沟油”禁止食用,但可以用来制肥皂 |
| B.PM2.5作为空气质量预报的一项重要指标,它是指空气中直径小于或等于2.5μm的颗粒物,该值越高,代表空气污染程度越严重。 |
| C.静电除尘治理悬浮颗粒污染,其依据是胶体的电泳原理 |
| D.为消除碘缺乏症,卫生部规定食盐中必须加含碘物质。在食盐中所加含碘物质是KI |
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
| A.与NaOH反应的氯气一定为0.3 mol |
| B.反应后的溶液中n(Na+):n(Cl-)可能为7:3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕1 |