在下列各反应中,水既不作氧化剂也不作还原剂的氧化还原反应是
| A.2F2+2H2O=4HF+O2 | B.Na2O+H2O=2NaOH |
| C.2Na+2H2O=2NaOH+H2↑ | D.Cl2+H2O=HCl+HClO |
反应2SO2+O2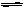 2SO3,经一段时间后,SO3的浓度增加了0.4 mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s),则这段时间为
2SO3,经一段时间后,SO3的浓度增加了0.4 mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s),则这段时间为
| A.0.1 s | B.2.5 s | C.5 s | D.10 s |
100 mL浓度为2 mol・L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
| A.加入适量的6 mol・L-1的盐酸 | B.加入数滴氯化铜溶液 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |
化学与环境、材料、信息、能源关系密切,下列说法正确的是
| A.绿色化学的核心是应用化学原理对环境污染进行治理 |
| B.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题 |
| C.PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 |
| D.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
将28 g铁粉放入100 mL 0.1 mol/L的CuSO4溶液中,充分反应后析出的铜的质量为
| A.32 g | B.6.4 g |
| C.0.64 g | D.3.2 g |
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应:
Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中,每生成1molAlN需转移3mol电子 |
| C.AlN中氮元素的化合价为+3 |
| D.AlN的摩尔质量为41g |