反应2SO2+O2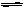 2SO3,经一段时间后,SO3的浓度增加了0.4 mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s),则这段时间为
2SO3,经一段时间后,SO3的浓度增加了0.4 mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s),则这段时间为
| A.0.1 s | B.2.5 s | C.5 s | D.10 s |
下列仪器不能在酒精灯火焰上直接加热的是()
| A.试管 | B.集气瓶 | C.蒸发皿 | D.燃烧匙 |
稀盐酸中混有少量硫酸,为了除去硫酸,可加入适量()
| A.铁屑 | B.氯化钡溶液 | C.硝酸银溶液 | D.氢氧化钠溶液 |
下列说法正确的是(NA表示阿伏加德罗常数)()
| A.在常温常压下,11.2升氯气含有的分子数为0.5NA |
| B.在常温常压下,1摩尔气体含有的原子数为NA |
| C.32g氧气所含原子数目为2NA |
| D.在同温同压下,相同体积的任何气体单质所含原子数目相同 |
胶体区别于其他分散系的本质特征是()
| A.光束穿过胶体时形成一条光亮的“通路” |
| B.胶体粒子大小在l nm ~ l00 nm 之间 |
| C.胶体粒子可以透过滤纸 |
| D.胶体粒子不能透过半透膜 |
下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是)
A.2H2O 2H2↑+O2↑ 2H2↑+O2↑ |
| B.Cl2+H2O=HCl+HClO |
| C.2F2+2H2O=4HF+O2 |
| D.2Na+2H2O=2NaOH+H2↑ |