NA为阿伏加德罗常数,下列叙述正确的是
| A.28gCO和N2混合气体中含有原子总数为2NA |
| B.标准状况下,22.4 LSO3所含的分子数为NA个 |
| C.足量铜与1L 18mol/L浓硫酸反应可以得到SO2的分子总数为9NA |
| D.1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去电子数为2NA |
在密闭容器中将CO和水蒸气的混合物加热到800℃时,有下列平衡:CO+H2O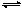 CO2+H2,且K=1。若用2molCO和10mol H2O相互混合并加热到800℃,则CO的转化率为()
CO2+H2,且K=1。若用2molCO和10mol H2O相互混合并加热到800℃,则CO的转化率为()
| A.16.7% | B.50% |
| C.66.7% | D.83.3% |
下列热化学方程式中,△H能正确表示物质的燃烧热的是()
| A.2CO(g) +O2(g) ==2CO2(g) △H=—566.0 kJ/mol |
| B.C(s) +1/2O2(g) ==CO(g) △H=—110.5 kJ/mol |
| C.CH4(g) +2O2(g)="=" CO2(g)+2H2O(l) △H=—890.31 kJ/mol |
| D.2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l) △H=—11036 kJ/mol |
已知下列反应的热化学方程式为:
(1)C(s)+O2(g)=CO2(g) ΔH 1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH 2=-870.3kJ/mol
(3)H2(g)+1/2O2(g)=H2O(l) ΔH 3=-285.8kJ/mol
则2C(s)+2H2(g)+O2(g) = CH3COOH(l)的反应热ΔH为()
| A.+488.3 kJ/mol |
| B.-488.3 kJ/mol |
| C.-244.15 kJ/mol |
| D.+244.15 kJ/mol |
可逆反应:2NO2 2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是()
2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是()
①单位时间内生成nmolO2的同时生成2nmolNO
②单位时间内生成nmolO2的同时生成2nmolNO2
③用NO2,NO,O2表示的反应速率的比为2∶2∶1的状态
④混合气体的压强不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
⑦混合气体的颜色不再改变的状态
| A.②④⑥⑦ | B.②③⑤⑦ |
| C.①③④⑤ | D.全部 |
在一定体积的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L,0.3mol/L,0.2mol/L。当反应达到平衡时,可能存在的数据是()
2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L,0.3mol/L,0.2mol/L。当反应达到平衡时,可能存在的数据是()
| A.N2为0.2mol·L-1,H2为0.6mol·L-1 |
| B.N2为0.15mol·L-1 |
| C.N2、H2均为0.18mol·L-1 |
| D.NH3为0.4mol·L-1 |