下列反应的离子方程式正确的是
| A.过氧化钠溶于水:2O22-+2H2O ="=" 4OH- + O2↑ |
| B.用小苏打治疗胃酸过多: CO32-+2H+ = CO2↑+H2O |
| C.硫酸铜与Ba(OH)2溶液反应: Cu2+ + 2OH-=Cu(OH)2↓ |
| D.碳酸氢钠溶液与NaOH溶液反应:HCO3-+OH- = CO32-+H2O |
下列说法可以证明反应N2+3H2 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
| A.1molN≡N键断裂的同时,有3molH—H键生成 |
| B.1molN≡N键断裂的同时,有3molH—H键断裂 |
| C.1molN≡N键断裂的同时,有6molH—H键断裂 |
| D.1molN≡N键断裂的同时,有6molH—H键生成 |
对于可逆反应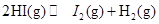 下列叙述能够说明反应已达平衡状态的是( )
下列叙述能够说明反应已达平衡状态的是( )
| A.各物质的物质的量浓度比为2∶1∶1 |
| B.压强保持不变的状态 |
| C.断裂2 mol H—I 键的同时生成1 mol I—I 键 |
| D.混合气体的颜色不再变化时 |
对于反应2SO2+O22SO3,下列判断正确的是( )
| A.2体积SO2和足量O2反应,必定生成2体积SO3 |
| B.其他条件不变,压缩体积来增大压强,反应速率必然加快 |
| C.平衡时,SO2消耗速率必定等于O2生成速率的两倍 |
| D.平衡时,SO2浓度必定等于O2浓度的两倍 |
下列关于平衡移动的说法不正确的是( )
| A.当v(正)=v(逆)时,平衡不移动 |
| B.当v(正)>v(逆)时,平衡向正反应方向移动 |
| C.当v(正)<v(逆)时,平衡向正反应方向移动 |
| D.反应速率发生改变,平衡不一定发生移动 |
在一定条件下,当单独改变可逆反应:N2(g)+3H2(g)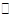 2NH3(g) ΔH<0的下列条件后,下列叙述中错误的是( )
2NH3(g) ΔH<0的下列条件后,下列叙述中错误的是( )
| A.加入催化剂,v正、v逆都发生变化,且变化的倍数相等 |
| B.增大压强,v正、v逆都增大,v正增大的倍数大于v逆增大的倍数 |
| C.降低温度,v正、v逆都减小,且v正减小的倍数小于v逆减小的倍数 |
| D.加入氩气,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 |