【物质结构与性质】
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。根据要求回答下列问题:
(1)基态Ni的价电子构型(电子排布式)为______________________。
(2)Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂,则Ni(CO)4属于_______晶体。
(3)Ni2+可与丁二酮肟(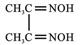 )作用生成腥红色配合物沉淀A。
)作用生成腥红色配合物沉淀A。
①丁二酮肟分子中碳原子的杂化轨道类型有______________,1mol该分子中含有的碳碳σ键和碳氮σ键的总数为__________。
②氨气在水中的溶解度远大于甲烷,其原因是____________。
③腥红色配合物沉淀A中(结构如右)除含有一般共价键外,还含有配位键和氢键,请在右图中标出配位键和氢键。(提示:Ni2+的配位数为4,配位键用“→”表示,氢键用“…”表示)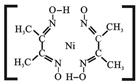
(4)据报道,某种含有镁、镍和碳三种元素的晶体具有超导性,该新型超导晶体的一个晶胞的结构如下图所示,则该晶体的化学式为__________ 。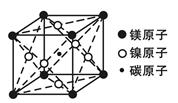
海水中化学资源的利用具有非常广阔的前景。
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下: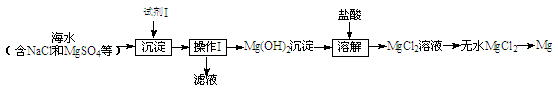
①试剂Ⅰ适宜选用(填序号)。
A.盐酸 B.石灰乳 C.氯化钠溶液
②操作Ⅰ的名称是。
③工业上通过电解熔融的MgCl2制备金属Mg,该反应的化学方程式是。
(2)下图是某课外小组在实验室模拟从海水中提取溴的实验装置。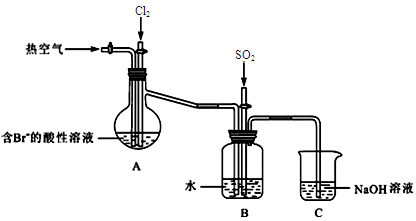
A装置中通入Cl2一段时间后,改通热空气,将Br2吹出至B装置。
①A装置中发生反应生成Br2的离子方程式为。
② B装置中,Br2被SO2还原,B装置中产生的两种主要阴离子的符号为、。
③C装置中NaOH溶液的作用是。
海水的综合利用可以制备金属镁,其流程如下图所示: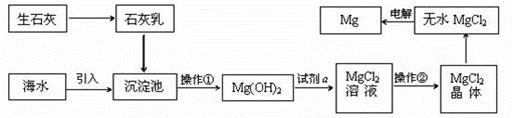
提示:①MgCl2晶体的化学式为MgCl2·6H2O;
②MgO的熔点为2852oC,无水MgCl2的熔点为714oC。
(1)操作②的名称是________、________、过滤。
(2)试剂a的名称是_______________________。
(3)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤_____________________________
_________________________________________________________________________。
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是_______________________________。
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明下列情况下使用玻璃棒的目的;
过滤时:__________________________、蒸发时:________________________
Ⅰ.将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
(1)通甲烷的铂丝为原电池的_______极,发生的电极反应为_______________。
(2)该电池工作时(放电)反应的总化学方程式为___________________________________。
Ⅱ.铅蓄电池是化学电源,它工作时的电池反应为:PbO2+Pb+2H2SO4===2PbSO4+2H2O;
试回答:
(3)铅蓄电池正极的电极材料是_____________。
(4)工作时该铅蓄电池负极的电极反应是_____________________。
(5)铅蓄电池工作时,电解质溶液的密度_______(填“减小”“增大”或“不变”,下同),pH_______。
(6)如果用铅蓄电池做电源电解饱和食盐水制取Cl2,当制得0.05molCl2时,在理论上电池内部消耗的H2SO4的物质的量是______________。
五种短周期元素D、E、F、X、Y、Z的原子序数依次增大,D、E两元素最高正价与最低负价之和均为0,E元素的一种同位素常用于考古断代,D和X同主族,F和Y同主族,F的多种化合物可用作化肥,豆科植物的根瘤菌可将其单质转化为化合物,X和Z形成的二元化合物是厨房常用的调味品。回答下列问题:
(1)①E元素在元素周期表中的位置是_______________。
②由D和F,Y,Z所形成的最简单常见共价型化合物中,热稳定性最差的是__________(用化学式表示,下同);还原性最强的是_____________。
③F、X、Z形成的简单离子半径从大到小顺序为_________________(用离子符号表示)
④D、F、Z形成一种离子化合物,写出它的电子式________________________。
(2)①2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是____________。
②F、X形成的一种二元离子化合物具有非常强的爆炸性,该物质中X的质量分数是35.38%,,则该物质的化学式为___________。
③Z单质和FD3发生置换反应,观察到有大量白烟生成,写出该反应化学方程式__________,反应中氧化剂和还原剂物质的量之比为____________________。
分某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了一系列实验,实验结果记录如下: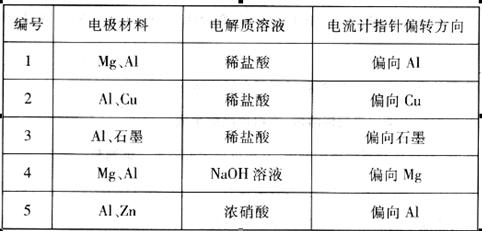
请根据上表中的实验记录回答下列问题:
(1)实验1、2中的Al所作的电极是否相同?____________________。
(2)在实验3中,Al作__________极,电极反应式为___________,电池总反应式为__________。
(3)实验4中的Al作正极还是负极?____________________,原因是____________________。
(4)解释实验5中电流计指针偏向Al的原因:__________________。
(5)根据实验结果,总结在原电池中金属铝作正极还是负极受到哪些因素的影响?____________________。