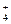化学家及其突出贡献为: ①波义耳(化学元素概念);②道尔顿(原子学说);③门捷列夫(元素周期律);④玻尔(玻尔原子模型)。这些突出贡献提出的年代顺序是
| A.①②③④ | B.②④①③ | C.③①④② | D.③④①② |
下列关于磷的叙述正确的是()
| A.红磷没有毒性而白磷有剧毒 |
| B.白磷在空气中加热到260 ℃转为红磷 |
| C.白磷可用于制安全火柴 |
| D.白磷不能保存在水中 |
在100 mL混合溶液中,HNO3和H2SO4的物质的量浓度都为0.4 mol·L-1。向该混合溶液中加入1.92 g Cu粉,加热充分反应后,所得溶液中Cu2+的物质的量浓度是()
| A.0.15 mol·L-1 | B.0.225 mol·L-1 |
| C.0.30 mol·L-1 | D.0.45 mol·L-1 |
将可能混有下列物质的硫酸铵样品13.2 g,在加热条件下与过量氢氧化钠溶液反应,可收集到气体4.3 L(标准状况),则该样品内不可能含有的物质是( )
| A.碳酸氢铵和硝酸铵 |
| B.碳酸铵和硝酸铵 |
| C.氯化铵和碳酸氢铵 |
| D.氯化铵和碳酸铵 |
把一小块钠投入浓氨水中,逸出的气体为( )
| A.全为H2 |
| B.全为NH3 |
| C.H2和NH3 |
| D.NH3·H2O |
下列反应的离子方程式正确的是( )
| A.次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2 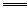 CaCO3↓+2HClO CaCO3↓+2HClO |
| B.硫酸亚铁溶液中加过氧化氢溶液 Fe2++2H2O2+4H+ 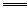 Fe3++4H2O Fe3++4H2O |
| C.用氨水吸收少量二氧化硫 NH3·H2O+SO2 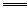 NH NH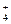 +HSO +HSO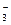 |
| D.硝酸铁溶液中加过量氨水 |
Fe3++3NH3·H2O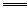 Fe(OH)3↓+3NH
Fe(OH)3↓+3NH