下列表示对应化学反应的离子方程式正确的是
| A.稀硝酸中加入过量铁粉:Fe + 4H+ + NO=== Fe3+ + NO↑ + 2H2O |
B.用铜作电极电解饱和食盐水:2Cl- + 2H2O 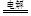 Cl2↑ + H2↑ + 2OH- Cl2↑ + H2↑ + 2OH- |
| C.氯化铝溶液中加入过量氨水:Al3+ + 3NH3·H2O=== Al(OH)3↓+ 3NH |
| D.向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+===Ba2++CO2↑+H2O |
下列关于有机物说法正确的是
| A.乙醇和乙酸都可以与氢氧化钠溶液反应 |
| B.75%(体积分数)的乙醇溶液常用于医疗消毒 |
| C.苯和乙烯都可以使溴的四氯化碳溶液褪色 |
| D.石油分馏可获得乙酸、苯及其衍生物 |
丙烯醇(CH2=CH—CH2OH)可发生的化学反应有
①加成②氧化③酯化④加聚⑤取代
| A.只有①②③ | B.只有①②③④ | C.①②③④⑤ | D.只有①③④ |
下列各组物质,一定是同系物的是
| A.分子式为C4H6和C5H8的烃 | B.分子式为CH4O和C2H6O的有机物 |
| C.符合CnH2n通式的烃 | D.分子式为C4H10和C20H42的烃 |
已知鲨烯分子含有30个C原子及6个C=C且不含环状结构,则其分子式为
| A.C30H50 | B.C30H52 | C.C30H56 | D.C30H60 |
下列物质中,不能使酸性KMnO4溶液褪色的是
①乙烯②乙烷③乙苯④乙炔⑤二氧化硫⑥甲苯⑦苯⑧异戊二烯
| A.②③⑥ | B.②③⑤⑥⑦⑧ | C.②⑦ | D.②⑤⑦ |