常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如右图所示[已知Ca3(PO4)2难溶于水]。下列有关说法不正确的是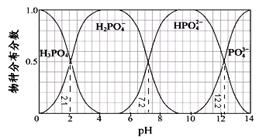
| A.H3PO4的Ka3=10-12.2,HPO42-的水解平衡常数为10-6.8 |
| B.Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性 |
| C.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 |
| D.pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+) |
常温下,用0.l000mol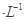 NaOH溶液滴定20.00mL0.1000 mol
NaOH溶液滴定20.00mL0.1000 mol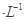 CH3COOH溶液所得滴定曲线如下图,下列说法正确的是
CH3COOH溶液所得滴定曲线如下图,下列说法正确的是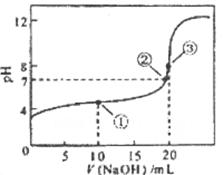
A.点①所示溶液中: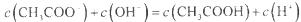 |
B.点②所示溶液中: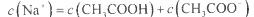 |
C.点③所示溶液中: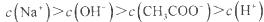 |
D.滴定过程中可能出现: |
在25℃时,将两个铂电极插入到一定量的Na2SO4饱和溶液中电解,通电一段时间后,在阴极逸出a mol气体,同时有Wg Na2SO4.10H2O晶体析出。若温度不变,此时剩余Na2SO4溶液的质量分数为
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式: |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,电解槽底部的阳极泥中只有Cu和Pt |
| D.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
下列叙述正确的是
A.0.1 mol 的硫酸铵溶液中: 的硫酸铵溶液中: |
B.0.1 mol 的硫化钠溶液中: 的硫化钠溶液中: |
C.1.0 l0 l0 mol/L盐酸的pH=3.0,1.0 mol/L盐酸的pH=3.0,1.0 10 10 mol/L盐酸的pH=8.0 mol/L盐酸的pH=8.0 |
| D.常温下,若1mL pH=1的盐酸与l00mL pH=l1NaOH溶液混合后,溶液的pH=7 |
下列各表述与示意图一致的是
A.图①表示25℃时,用0.1 mol 盐酸滴定20 mL 0.1 mol 盐酸滴定20 mL 0.1 mol NaOH溶液,溶液的pH随加入酸体积的变化 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应: 正、逆反应的平 正、逆反应的平衡常数K随温度的变化 |
C.图③表示10 mL 0.0l mol KMnO4酸性溶液与过量的0.1 mol KMnO4酸性溶液与过量的0.1 mol H2C2O4溶液混合时,n(Mn2+)随时间的变化 H2C2O4溶液混合时,n(Mn2+)随时间的变化 |
| D.I为较强酸稀释时pH变化的曲线,且b点溶液的导电性比c点溶液的导电性弱 |