(18分)
Ⅰ.(7分)次磷酸(H3PO2)是一种一元中强酸,具有较强的还原性。试回答下列问题:
(1)P的原子结构示意图为 ;
(2)NaH2PO2为 (填“正盐”或“酸式盐”),溶液中有关离子浓度从大到小的顺序为 。
(3)H3PO2可将溶液中的银离子还原为银单质,若氧化剂与还原剂的物质的量之比为4︰1,则该反应的氧化产物的化学式为 。
Ⅱ.(11分)某无机化合物A的相对分子质量为184。在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液的pH<7。将18.4gA隔绝空气加强热可得到12.8g B和气体单质C。请回答下列问题:
(1)A的化学式为 ,C的电子式为 。
(2)写出SCl2与氨反应的化学方程式: 。
(3)亚硝酸钠和X固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。
(4)请设计检验物质X的实验方案: 。
下图为相互串联的甲、乙两电解池试回答:
(1)若甲池利用电解原理在铁上镀银,则A是 (填电极材料),电极反应式是 ;B是 (填电极材料),电极反应式是 ,应选用的电解质溶液是 。
(2)乙池滴入少量酚酞试液,电解一段时间, (填“C”或“Fe”)极附近呈红色。
(3)若甲槽阴极增重43.2g,则乙槽中阳极上放出的气体在标况下的体积是 _________L。
某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等)来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程。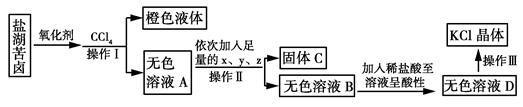
研究性学习小组查寻资料得知:Br-被氧化剂氧化成溴。溴不易溶于水而易溶于CCl4回答以下问题:
(1)操作Ⅰ的名称为______________;要从橙色液体中分离出溴,所采取的操作需要的主要玻璃仪器除酒精灯和温度计外,还有________ 。
(2)试剂x,y,z的化学式分别为x,_______ y z _;检验SO42-已除尽的方法是 。
(3)写出操作Ⅲ的具体操作步骤_________________________。
2 mol O3和3 mol O2的质量之比______________,分子数之比______________,同温同压的密度之比为______________,含氧原子数之比为______________,体积之比为______________。
有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、Na2SO4。首先不用其他试剂就可鉴别出的是 ,如要继续鉴别余下两种,还需要选用的试剂是 ,现象分别为 。
对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸发、③蒸馏、④萃取、⑤加热分解等。下列各组混和物的分离或提纯应采用什么方法?(填序号)
(1)提取碘水中的碘 ____________________
(2)除去食盐溶液中的水 ______________________
(3)淡化海水 ______________________
(4)KCl中含有KClO3_____________________