铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O ZnFe2(C2O4)3·6H2O↓…………(a)
ZnFe2(C2O4)3·6H2O↓…………(a)
ZnFe2(C2O4)3·6H2O  ZnFe2O4 + 2CO2↑+4CO↑+6H2O …………(b)
ZnFe2O4 + 2CO2↑+4CO↑+6H2O …………(b)
已知:ZnC2O4和FeC2O4难溶于水。
(1)上述制备原理中不属于氧化还原反应的是 (选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ.(NH4)2Fe(SO4)2·6H2O
Ⅱ.ZnSO4·7H2O
Ⅲ.(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n (Zn2+)= 。
②选用的加料方式是 (填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,再升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成溶液乙,甲、乙同时加热到
75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤完全的依据是 。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有 。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。
实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1稀硫酸,加入 (选填字母,下同)。
A.30%H2O2 B.新制氯水 C.FeCl3溶液 D.KSCN溶液
②加入 。
A.纯锌粉 B.纯碳酸钙粉末 C.纯ZnO粉末 D.3mol·L-1稀硫酸
③加热到60℃左右并不断搅拌。
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是 。
某研究小组探究SO2和Fe(NO3)3溶液的反应,其反应装置如下图所示: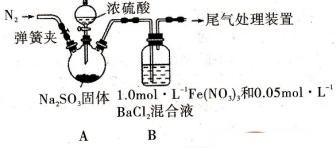
已知:l.0mol·L-1的Fe(NO3)3溶液的pH=l,请回答下列问题:
(1)装置A中反应的化学方程式是。
(2)为排除空气对实验的干扰,滴加浓硫酸之前进行的操作是。
(3)装置B中产生了白色沉淀,其成分是,说明SO2具有性。
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO3-反应;
猜想3:……
(4)甲同学从装置B中取出适量反应后的溶液,能使KMnO4溶液褪色。
【得出结论】猜想1成立。其结论正确吗?(填是或否)。
若不正确,理由是________(正确无需回答)。
(5)乙同学设计实验验证猜想2,请帮他完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生。除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等。)
| 实验步骤(不要求写具体操作过程) |
预期现象和结论 |
| ①配溶液____________________。 ②…… |
(6)在实际操作中,当SO2通入Fe(NO3)3溶液时观察到的现象;溶液由黄色变为浅绿色,接着又变为黄色,请用相关离子方程式表示其过程、。
(I)已知:R-OH+HX→R-X+H2O。右图是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置。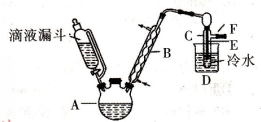
有关数据见下表:乙醇、溴乙烷、溴有关参数
| 乙醇 |
溴乙烷 |
溴 |
|
| 状态 |
无色液体 |
无色液体 |
深红棕色液体 |
| 密度/g•cm-3 |
0.79 |
1.44 |
3.1 |
| 沸点/℃ |
78.5 |
38.4 |
59 |
(1)制备操作中,加入的浓硫酸必需进行稀释,其目的是。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(2)加热的目的是(从速率和限度两方面回答);应采取的加热方式是。
(3)为除去产品中的一种主要杂质,最好选择下列_____溶液来洗涤产品。
A.氢氧化钠B.碘化钠C.亚硫酸钠
(4)第(3)步的实验所需要的主要玻璃仪器是。
(Ⅱ)苯甲酸甲酯( )是一种重要的工业有机溶剂。请分析下列有机物的结构简式或性质特点,然后回答问题。
)是一种重要的工业有机溶剂。请分析下列有机物的结构简式或性质特点,然后回答问题。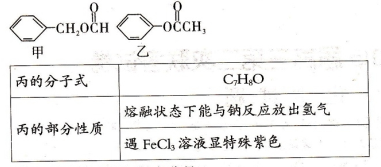
(1)乙中含氧官能团的名称是。
(2)甲、乙、丙三种有机物中与苯甲酸甲酯是同分异构体的是。与NaOH溶液在加热条件下反应消耗NaOH最多的是。
(3)符合丙条件的结构可能有________,种,写出其中两种。
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是(填序号)。
A.往烧瓶中加MnO2B.加热C.加浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中c(HCl),探究小组同学提出下列实验方案。
甲方案:与足量AgNO3溶液反应,测定m(AgCl)。
乙方案:酸碱中和滴定法测定。
丙方案:与足量Zn反应,测定V(H2)。继而进行下列判断和实验:
①判定甲方案不可行,理由是。
②进行乙方案实验:将残余清液稀释10倍后作为试样。量取试样20.00mL,用0.1000mol·L—1NaOH标准溶液滴定,消耗22.00mL,则残余清液中c(HCl)为mol·L—1。
③进行丙方案实验:装置如图所示(夹持仪器已略去)。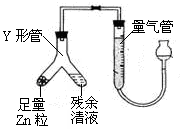
(i)使Y形管中的残余清液与锌反应的正确操作是将转移到中。
(ii)反应完毕,每间隔1分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是(排除仪器和实验操作的影响因素)。
(16分)某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。
实验步骤及现象如下:
①检查装置气密性后,装人药品并连接仪器:
②缓慢通人一定量的N2后,将装置D连接好(导管末端未伸人集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸人集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通人一定量的N2,至装置中气体无色。
(1)装置B中的湿润的红色纸条褪色,证明A中反应有_______(填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因______________。
(2)装置C的作用是______________________________________________。
(3)甲同学认为O2是 Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①____________________________________;②______________________________。
(4)实验证明,Na2O2与干燥的HCl能反应,得到Cl2,请写出该的化学方程式:_______________;该反应一般不用于实验室快速制取纯净的Cl2,理由是________________________________。
为探索工业废料的再利用,某化学兴趣小组设计了如下左图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。请回答下列问题:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是,该操作中除用到烧杯和玻璃棒外,还必须用到的玻璃仪器有。
(2)溶液A中的离子主要有Na+、OH-、;试剂X是。
(3)进行步骤Ⅱ时,该小组用如上图所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是(用离子方程式表示);为了避免固体C减少,改进的措施是在装置Ⅰ、Ⅱ之间增加一个盛有饱和溶液的洗气瓶。
(4)从溶液E中获得绿矾晶体的实验操作依次为(填操作名称)、冷却结晶、过滤洗涤。