在200mL氯化铁和氯化铝的混合液中,Fe3+的物质的量浓度为0.2mol/L,Cl-的物质的量浓度为1.8 mol/L。要使Fe3+全部转化为沉淀分离出来,至少需要加入 4 mol/L NaOH溶液的体积为
| A.30mL | B.110mL | C.90mL | D.180mL |
下列说法正确的是
| A.紫色石蕊试液中通入二氧化硫,溶液先变红后褪色 |
| B.将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 |
| C.硫粉在过量的纯氧中燃烧可以生成大量的SO3 |
| D.富含硫黄的矿物在工业上可用于制造硫酸 |
在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)  2NO2(g),若N2O4的浓度由0.1mol/L降到0.07mol/L时,需要15 s,那么N2O4的浓度由0.07mol/L降到0.05mol/L时,所需反应的时间为
2NO2(g),若N2O4的浓度由0.1mol/L降到0.07mol/L时,需要15 s,那么N2O4的浓度由0.07mol/L降到0.05mol/L时,所需反应的时间为
| A.等于5s | B.等于10s | C.大于10s | D.小于10s |
下列事实中,能用勒夏特列原理解释的是
A.对于反应2HI(g)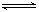 H2(g)+I2(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 H2(g)+I2(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 |
| B.实验室常用排饱和食盐水法收集氯气 |
| C.硫酸工业中,加催化剂有利于三氧化硫的生成 |
D.2SO2 + O2 2SO3的反应条件不是室温,是500℃左右 2SO3的反应条件不是室温,是500℃左右 |
可用一种试剂鉴别KCl、Ba(OH)2、Na2CO3、K2SO3四种溶液,该试剂是
| A.BaCl2 | B.H2SO4 | C.KOH | D.HCl |
常温下,能促进水的电离的物质是
| A.醋酸 | B.NaOH溶液 | C.Na2CO3溶液 | D.硫酸 |