向微型实验仪器井穴板的4个井穴(已编号1、2、3、4)中分别滴加盐酸、醋酸、硫酸铝和氯化铵(所有试剂用量共约0.8mL),观察到四种溶液均变化。
(1)本实验说明这四种溶液都显________性。
(2)由此实验的过程和现象你还能得出哪些结论。__________________________________.
用下图所示装置进行CO和CO2的分离与干燥(其中A为弹簧夹,B为分液漏斗活塞)。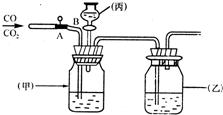
已知:浓硫酸具有很强的吸水性;氢氧化钠溶液可以快速吸收二氧化碳,若将二氧化碳通入足量的氢氧化钠溶液可以生成碳酸钠和水,该反应的化学方程式为。
(1)广口瓶(甲)中盛有;广口瓶(乙)中盛有浓硫酸,其作用是;分液漏斗(丙)中盛有。
(2)先分离出的气体是;丙中液体将后一种气体分离出时发生反应的化学方程式为。
下列为实验室常用的实验装置,回答问题: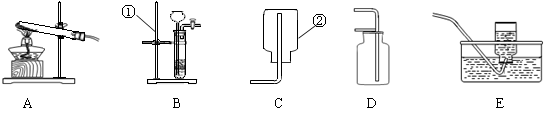
(1)写出带有标号仪器的名称:①;②。
(2)用锌粒和稀硫酸在常温下反应制取氢气,应选用的发生装置是(填序号,下同),收集装置是。
(3)实验室常用(填药品名称)反应制CO2,该反应的化学方程式为;此外,也可用加热碳酸氢钠(NaHCO3)固体(产物为碳酸钠、二氧化碳、水)来制取CO2,该反应的化学方程式为,
若用此法来制取CO2,应选用的发生装置为,收集装置为。
(4)右图所示装置可用来测量生成的CO2的体积,其中在水面上放一层植物油的目的是
,植物油上方原有的空气对实验结果(填“有”或“无”)明显影响。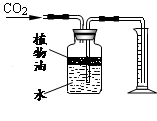
中国2010上海世博会的主题是“城市,让生活更美好”。
(1)世博园区内使用电动车,有效减少了CO、CO2、SO2的排放,这些物质中会引起温室效应的是_________,会引起酸雨的是_______,能与血液里的血红蛋白结合造成人体中毒的是_______。
(2)世博园区内用“活性炭+超滤膜+紫外线”组合工艺获得直饮水。其中活性炭起________作用;用紫外线代替氯气对水进行处理,其作用是_________。
(3)世博会上所使用的饭盒、胸卡、证件等都用可完全降解的“玉米塑料”制成,制作的第一步是将玉米发酵制得乳酸(C3H6O3)。乳酸由_______种元素组成,其中碳元素的质量分数为_________。
硝酸可发生反应: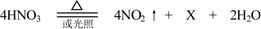 。据此回答:
。据此回答:
(1)反应的基本类型属于反应,硝酸(HNO3)氮元素的化合价为。
(2)X的化学式为,推断的依据为。
(3)硝酸的保存应注意、。
完成下列化学反应的化学方程式:
(1)电解水:_________________________________________________________________
(2)硫在空气中的燃烧:_______________________________________________________
(3)高锰酸钾制氧气:
(4)有水生成的分解反应:_____________________________________________________
(5)有水生成的化合反应:_____________________________________________________