下列事实不能用勒夏特列原理解释的是
A.氯水中有平衡:Cl2+H2O HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 |
B.对CO(g)+NO2(g) CO2(g)+NO(g),平衡体系增大压强可使颜色变深 CO2(g)+NO(g),平衡体系增大压强可使颜色变深 |
C.对2NO2(g)  N2O4(g) △H<0, 升高温度平衡体系颜色变深 N2O4(g) △H<0, 升高温度平衡体系颜色变深 |
| D.SO2催化氧化成SO3的反应,往往加入过量的空气 |
下列各组离子在指定分散系中一定能大量共存的是
A.pH=0的溶液中: 、Fe3+、 、Fe3+、 、Cl- 、Cl- |
B.明矾溶液中:Na+、Mg2+、 、 、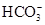 |
| C.氢氧化铁胶体中:H+、K+、Cl-、S2- |
D.使酚酞变红的溶液中:Na+、Ba2+、Cl-、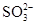 |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.由2H和18O组成的水11 g,所含的中子数为4NA |
| B.标准状况下11.2 L乙烷和乙烯的混合气体中含有C原子数为NA |
| C.在0.1 mol·L-1的醋酸溶液中,所含H+的个数小于0.1NA |
| D.室温下H2O2分解得到16 g O2,转移的电子数为2NA |
下列说法正确的是
| A.氧化剂得电子数越多其氧化能力越强 | B.发生化学键断裂的过程不一定发生化学反应 |
| C.常温下所有的吸热反应都不能自发进行 | D.两种难溶物溶解度小的物质其Ksp一定也小 |
下列物质的分类依据正确的是
| 物质类别 |
分类依据 |
|
| A |
酸 |
电离时能否产生氢离子 |
| B |
碱性氧化物 |
是否属于金属氧化物 |
| C |
胶体 |
能否发生丁达尔现象 |
| D |
强电解质 |
水溶液中能否完全电离 |
下列物质间的转化关系中不能全部通过一步反应完成的是
| A.Na→NaOH→Na2CO3→NaCl | B.Mg→MgCl2→MgCO3→Mg(OH)2 |
| C.Al→Al2O3→Al(OH)3→AlCl3 | D.Fe→FeCl3→Fe(OH)3→Fe2O3 |