直接填写计算结果:
(1)标准状况下3.36 L某气体的质量为8.1 g,则该气体的摩尔质量为 g/mol。
(2)某块光卤石(KCl·MgCl2·6H2O)中含5.3250 g Cl-,则该光卤石的物质的量为 mol。
(3)11.2 g 铁粉与足量的稀硫酸反应生成的氢气在标准状况下的体积为 L。
(共16分) 硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:
① Na2SO4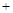 4C
4C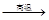 Na2S
Na2S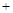 4CO↑
4CO↑
② Na2SO4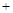 4CO
4CO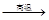 Na2S
Na2S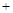 4CO2
4CO2
(1)、现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4) g(精确到0.01);
(2)、若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量n的范围是
<n< ;
(3)、若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y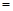 ;
;
(4)、Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量硫酸,充分反应后,过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各成分的物质的量分别为 。
(请写出计算过程)
已知 2 mol SO2 (g) 氧化为2 mol SO3 (g) 的能量变化如图所示:
(1)写出SO2 (g) 氧化为SO3 (g) 的热化学方程式:
(2)氧化SO2时,工业上常加入V2O5作催化剂,其反应机理可表示为
SO2 + V2O5 = SO3 + 2VO2, 4VO2 + O2 = 2V2O5;
上图中表示加入V2O5的反应曲线为(填“a”或“b”)。
(3)若在容积为2 L的密闭容器中充入2 mol SO2 (g)和1 mol O2 (g),如图甲所示,经2 min达到平衡,测得放出热量为178.2 kJ,则:
①2 min内 O2的化学反应速率v(O2)=;
②若再充入1 mol O2重新达到平衡时,SO3平衡浓度的取值范围是:。
(4)若将2 mol SO2 (g)和1 mol O2 (g)充入容积可变的容器乙中,初始体积为2 L,达到平衡时放出热量Q kJ,则Q178.2 kJ(填“>”,“=”或“<”)。
利用铜棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当铜棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗。请回答下列问题:
(1)该原电池的正极反应式为:
(2)计算原稀硫酸的物质的量浓度。
(3)若将铜棒换成铁片,仍按题给方式组合起来,能否组成原电池呢?(填“能”或“不能”)若能组成原电池,此原电池的负极反应式是
(10分计入总分)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如下图的反应,各物质量起始加入量如下:M为2.5moL,N为3mol,P为0 mol。A、C、D各为0.5mol, B为Xmol,当X在一定范围内变化时,均可以调节反应器的温度,使两侧面反应达平衡,并且隔板刚处于中间位置。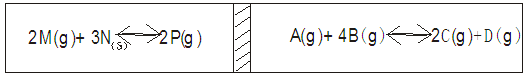
若达平衡后,测得M的转化率为75%,请读写下列空白。
①达平衡后,反应左室气体总的物质的量为。
②若欲使右室V正>V逆,X的取值范围是。
③若欲使右室反应V逆>V正,X的取值范围是。
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入2.0 mol·L-1 Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子
(2)试通过计算确定该结晶水合物的化学式
(3)试通过计算确定若只加入75mL的Ba(OH)2溶液,得到的沉淀质量。