(选做)现有浓度均为0.1 mol/L的下列溶液:①硫酸.②醋酸.③氢氧化钠.④氯化铵.⑤醋酸铵.⑥硫酸铵.⑦硫酸氢铵.⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)________________.
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)________________.
(3)将③和④等体积混合后,溶液中各离子浓度由大到小的顺序是______ .
(4)已知t℃时,KW=1×10-13,则t℃(填“>”.“<”或“=”)______25℃.在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b________.
A、B、C、D都是中学化学中的常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。
(1)若A是一种强碱,C为厨房中的用品。
①反应Ⅲ的离子方程式是__________________________________。
②下列有关B、C的说法正确的是
A.向B的饱和溶液中通入D,将有晶体析出
B.可以用BaCl2或CaCl2稀溶液或Ba(OH)2稀溶液鉴别B、C两种溶液
C.分别取等质量的B、C两种固体与足量盐酸反应C产生气体多
D.取a克B、C的混合物充分加热,固体质量减重b克,由此可计算出混合物中B的质量分数
E.取a克B、C的混合物与足量稀硫酸充分反应,逸出的气体用碱石灰完全吸收,增重b克, 由此可计算出混合物中B的质量分数
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅲ的离子方程式是__________________________________。
②向沸水中逐滴加入5~6滴B的饱和溶液,继续煮沸至溶液呈红褐色,该反应的化学方程式为:。区分该分散系与其它分散系最本质的特征是。
⑶若常温下A、C是气体,B是固体。
①反应Ⅲ的化学方程式是__________________________________.
有两瓶经过C气体和(2)中的A气体漂白的品红溶液,如何通过简单实验进行鉴别?
。
③在BaCl2溶液中通入C气体,未见沉淀生成,若先通入下列的另一种气体,再通入C;或者向通入C气体的BaCl2溶液中加入下列物质,可以看到沉淀的有_______(填序号)。
A、Cl2 B、NH3 C、HCl D、CO2E、KNO3
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)以天然气为原料制H2是合成氨的一条重要的路线。甲烷的部分氧化可得到合成氨的原料气H2,其反应式如下:
①CH (g)+1/2O
(g)+1/2O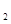 (g)=CO(g)+2H
(g)=CO(g)+2H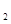 (g)
(g) H1=-35.6kJ·mol
H1=-35.6kJ·mol
试判断常温下,上述反应能否自发进行:(填”能”或”否”)。有研究认为甲烷部分氧化的机理为:
②CH (g)+2O
(g)+2O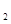 (g)=CO2(g)+2H2O(g)
(g)=CO2(g)+2H2O(g) H2=-890.3kJ·mol
H2=-890.3kJ·mol
③CH (g)+CO
(g)+CO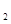 (g)=2CO(g)+2H
(g)=2CO(g)+2H (g)
(g) H3=247.3kJ·mol
H3=247.3kJ·mol
请结合以上条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:
。
⑵恒温下,向一个2L的密闭容器中充入1 molN2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
实验数据
| 时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
| c(NH3)/( mol ·/L-1) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
此条件下,该反应达到化学平衡时,氮气的浓度为。
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①b处电极上发生的电极反应式是。
②电镀结束后,装置Ⅰ中溶液的pH(填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu 的物质的量浓度。
的物质的量浓度。
③若完全反应后,装置Ⅱ中阴极质量增加12.8g,则装置Ⅰ中理论上消耗甲烷L (标准状况下)。
随着世界工业经济的发展、人口的剧增,全球能源紧缺面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为: C(s)+H2O(g) CO(g)+H2(g)△H=+131.5kJ·mol-1
C(s)+H2O(g) CO(g)+H2(g)△H=+131.5kJ·mol-1
①该反应的平衡常数表达式为。
②下列措施中,不能提高碳的转化率的是(填字母序号)
| A.容器的体积不变,增加水蒸气的物质的量 | B.缩小容器的体积,增大压强 |
| C.及时将水煤气从容器中移走 | D.其他条件不变,升高温度 |
 ③又知C(s)+CO2(g) 2CO(g)△H=+172.5kJ·mol-1
③又知C(s)+CO2(g) 2CO(g)△H=+172.5kJ·mol-1 则CO(g)+H2O(g) CO2(g)+H2(g)的焓变(△H)为。
则CO(g)+H2O(g) CO2(g)+H2(g)的焓变(△H)为。 (2)CO和H2在一定条件下可反应生成甲醇,CO(g)+2H2(g) CH3OH(g)。甲醇作为一种可再生能源燃料,可用于燃料电池。下图是甲醇燃料的原理示意图:
(2)CO和H2在一定条件下可反应生成甲醇,CO(g)+2H2(g) CH3OH(g)。甲醇作为一种可再生能源燃料,可用于燃料电池。下图是甲醇燃料的原理示意图:
①a处通入的是(填物质名称),该电池工作过程中,H+的移动方向
为从到(填“左”或“右”)
②该电池正极反应式为。
③若用该电池提供的电能电解600ml 0.2mol·L-1NaCl溶液,设有0.01molCH3OH完全放电,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解时阴极反应式为,电解结束后所得溶液的pH=。若向电解后的溶液加入适量的醋酸至溶液的pH恰好等于7(反应前后忽略溶液体积的变化),则此时溶液中c(Na+):c(CH3COO-)=。
某校化学兴趣小组为探究SO2气体的还原性设计了如下装置图:
(1)SO2气体还原Fe3+的离子反应方程式为;
(2)实验中所需的SO2气体可以用浓硫酸和铜反应来制取,该反应的化学方程式为
,在反应表现了H2SO4的哪些性质。
(3)装置C的作用是。
(4)若要从A中得到溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有(填字母序号)。
| A.蒸发皿 | B.石棉网 | C.漏斗 | D.烧杯 |
E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,不变红,紫色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀
上述方案不合理的一个方案(填数字序号),原因是。
(6)上述装置中能表明I-的还原性弱于SO2的现象是。
构成物质的微粒很多,离子就是构成物质的基本微粒之一,下表是中学化学中常见的几种离子:
回答下列问题:
(1)K+离子的结构示意图,Cl在周期表中的位置是。
(2)将含OH-离子的溶液滴入浓度为0.1mol/L的Al3+和NH+4的混合溶液中,若测得溶液中NH+4减少了一半,则此时溶液中(填“存在”或“不存在”)大量的Al3+。
(3)物质A和B分别由上表中的两种离子组成,将它们分别溶于水中,A的溶液显酸性,B的溶液显碱性且B的焰色反应呈紫色(透过蓝色钻玻璃观察),将A、B两溶液混合,既有白色沉淀生成,又有无色无味的气体生成。则A中含有的阳离子是,B溶液显碱性的原因是(用离子方程式和必要的文字说明)。
(4)常温下,将(NH4)2CO3溶于水,得到含有大量NH4+和CO2-3的溶液,往溶液中滴入少量氨水,测得溶液中NH+4和CO2-3的浓度比为2:1,则此时该溶液的pH(填“<”、 “=”或“>”)7。
(5)在微生物作用下的条件,NH+4可被空气氧化成NO-3。写出该反应的离子方程式
。