下列实验方案不能证明醋酸是弱电解质的是
| A.往0.10 mol/L CH3COOH溶液中加CH3COONa固体,pH增大 |
| B.用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,两者的pH相差小于1个单位。 |
| C.对盐酸和醋酸溶液进行导电性实验,与CH3COOH溶液相串联的灯泡较暗。 |
| D.室温,PH=3的醋酸与PH=11的NaOH溶液等体积混合,溶液PH<7。 |
下列叙述中,正确的是( )
| A.甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g) + 2O2(g) ="==" CO2(g) + 2H2O(g) ΔH=-890.3 kJ·mol-1 |
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应,放热19.3 kJ,其热化学方程式为: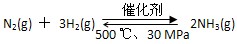 ΔH=-38.6 kJ·mol-1 ΔH=-38.6 kJ·mol-1 |
| C.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 |
| D.常温下,反应C(s) + CO2(g) ="==" 2CO(g)不能自发进行,则该反应的ΔH>0 |
下列有关金属腐蚀与防护的说法正确的是()
| A.纯银器表面在空气中因电化学腐蚀渐渐变暗 |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
关于下列装置说法正确的是
| A.装置①中,盐桥中的K+移向ZnSO4溶液 |
| B.装置②工作一段时间后,a极附近溶液的pH增大 |
| C.用装置③精炼铜时,c极为粗铜 |
| D.装置④中电子由Zn流向Fe,装置中有Fe2+生成 |
银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
2Ag+Zn(OH)2  Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是
Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是
| A.Ag | B.Zn | C.Ag2O | D.Zn(OH)2 |
下列关于化学反应的自发性的叙述中正确的是()
| A.焓变小于0而熵变大于0的反应肯定是自发的 |
| B.焓变和熵变都小于0的反应肯定是自发的 |
| C.焓变和熵变都大于0的反应肯定是自发的 |
| D.焓变大于0而熵变小于0的反应肯定是自发的 |