在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L—l |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L—l |
0.05 |
0.05 |
0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y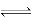 2Z,其化学平衡常数为1600
2Z,其化学平衡常数为1600
C.增大压强可使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的化学平衡常数
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子.在a g HmX中所含质子的物质的量是( )
A. (A-N+m) mol (A-N+m) mol |
B.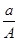 (A-N) mol (A-N) mol |
C. (A-N) mol (A-N) mol |
D. |
下列氢化物中稳定性由强到弱的顺序正确的是( )
| A.CH4>NH3>H2O>HF | B.SiH4>NH3>H2S>HCl |
| C.HF>H2O>NH3>PH3 | D.NH3>PH3>H2S>HBr |
下列关于碱金属的原子结构和性质的叙述中不正确的是( )
| A.碱金属原子最外层都只有一个电子,在化学反应中容易失去 |
| B.碱金属单质都是强还原剂 |
| C.碱金属单质都能在O2中燃烧生成过氧化物 |
| D.碱金属单质都能与水反应生成碱 |
X元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为()
| A.HX | B.H2X | C.XH4 | D.XH3 |
下列粒子:①质子 ②中子 ③电子,在所有原子中均含有的粒子是( )
| A.①②③ | B.仅① | C.①和③ | D.①和② |