短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。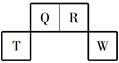
(1)T的原子结构示意图是______。用化学方程式表示工业上常用于冶炼T单质的原理是_________。
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子中的共价键类型是________ 。
(3)元素的非金属性:Q________W(填“强于”或“弱于”),结合方程式简述其原因是___________。
(4)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式___________________________________。
元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R、N、T分别代表某种化学元素。请依据这9种元素回答下列问题。
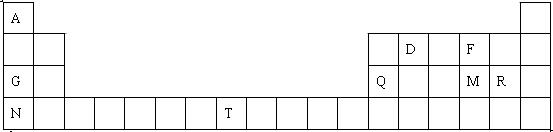
(1)表中T的元素符号为,金属性最强的元素是(填元素符号)。 (2)元素的非金属性:MR(填“>”或“<”)。
(2)元素的非金属性:MR(填“>”或“<”)。 (3)R的最高价氧化物对应水化物的化学式是。
(3)R的最高价氧化物对应水化物的化学式是。 (4)F、G两元素形成的淡黄色固体物质的电子式为,该物质含有的化学键的类型是。
(4)F、G两元素形成的淡黄色固体物质的电子式为,该物质含有的化学键的类型是。 (5)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)。
(5)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)。 (6)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为。
(6)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为。 (7)A与D形成分子的空间结构可能是(填序号)。
(7)A与D形成分子的空间结构可能是(填序号)。
工业上制备BaCl2的工艺流程图如下:
某研究小组在实验室 用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s)  4CO(g) + BaS(s)△H1 =" 571.2" kJ·mol-1①
4CO(g) + BaS(s)△H1 =" 571.2" kJ·mol-1①
BaSO4(s) + 2C(s)  2CO2(g) + BaS(s)△H2=" 226.2" kJ·mol-1②
2CO2(g) + BaS(s)△H2=" 226.2" kJ·mol-1②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为。
(2)反应C(s) + CO2(g)  2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
(3)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
①下列措施中,有利于降低大气中CO2浓度 的有:。(填字母)
的有:。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
②将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O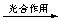 C6H12O6 b.CO2 + 3H2
C6H12O6 b.CO2 + 3H2 CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4 CH3COOH d.2CO2 + 6H2
CH3COOH d.2CO2 + 6H2 CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反应中,最节能的是,原子利用率最高的是。
 W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数一次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红
W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数一次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红 色(或砖红色)的
色(或砖红色)的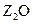 和黑色的ZO两种氧化物。
和黑色的ZO两种氧化物。 (1)W位于元素周期表第_________周期第_________族。W的气态氢化物稳定性比
(1)W位于元素周期表第_________周期第_________族。W的气态氢化物稳定性比
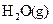 __________(填“强”或“弱”)。
__________(填“强”或“弱”)。 (2)Y的基态原子核外电子排布式是________,Y的第一电离能比X的__________(填“大”或“小”)。
(2)Y的基态原子核外电子排布式是________,Y的第一电离能比X的__________(填“大”或“小”)。 (3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是 ______________________________________________________________________。
______________________________________________________________________。
(4)
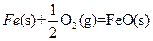
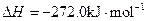

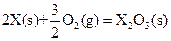
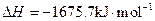
 X的单质和FeO反应的热化学方程式是_________________________________________。
X的单质和FeO反应的热化学方程式是_________________________________________。
(12分) 铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
 (1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应: Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g) ①该反应的平衡常数表达式为:K=
①该反应的平衡常数表达式为:K= ②该温度下,在2L盛有
②该温度下,在2L盛有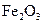 粉末的密闭容器中通入CO气体,10min后,生成了单
粉末的密闭容器中通入CO气体,10min后,生成了单 质铁11.2g。则10min内CO的平均反应速率为
质铁11.2g。则10min内CO的平均反应速率为 (2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态: ①②
①② (3)写出氢氧化铝在水中发生碱式电离的电离方程式:
(3)写出氢氧化铝在水中发生碱式电离的电离方程式: 欲使上述体系中
欲使上述体系中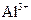 浓度增加,可加入的物质是。
浓度增加,可加入的物质是。
水的电离平衡曲线如下图所示。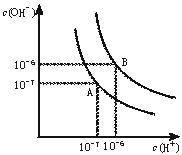
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度 下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积为
下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积为 。
。