某工厂废弃的钒渣中主要含V2O5、VOSO4、K2SO4、SiO2等,现从该钒渣回收V2O5的工艺流程示意图如下:
(已知:沉淀为(NH4)2V6O16,全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂)。
R2(SO4)n(水层)+2nHA(有机层) 2RAn(有机层) + nH2SO4(水层)
2RAn(有机层) + nH2SO4(水层)
回答下列问题:
(1)(NH4)2V6O16中钒(V)的化合价为 ,①中产生的废渣的主要成分是 。
(2)工艺中反萃取所用的X试剂为 。
(3)为提高②中萃取效率,应采取的措施是 。
(4)请完成④中的反应离子方程式:
(5)成品V2O5可通过铝热反应来制取金属钒,写出该反应的化学方程式: 。
(6)将两个全钒液流储能电池串联后作为电源,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,装置如下:
b为电解池的 极,全钒液流储能电池正极的电极反应式为 ;
若通过消毒液发生器的电子为0.2 mol,则消毒液发生器中理论上最多能产生 gNaClO。
(共10分)回答下列有关周期表的问题:
(1)在下图所示元素周期表中请用实线(黑色中性笔)画出主族元素的边界。
(2)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A。写出A的电子式________。
(3)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式_____________________________________________________________
(4)金属元素丙形成的某化合物的溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是________________(用离子符号表示)
(5)丁与戊分别是第三周期中简单离子半径最小和最大的金属元素,写出丁元素的单质与戊最高价氧化物对应的水化物溶液反应的离子方程式_____________________。
(共12分)物质之间的转化关系如下图,其中A、D、E、F、H为常见单质,其余为化合物,且单质E和单质F在点燃或加热的条件下生成淡黄色的固体,B常温下为液态化合物。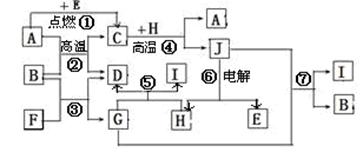
试回答下列有关问题:
(1)A在元素周期表的位置周期族。
(2)分别写出反应②⑦的化学方程式;。
(3)写出引发反应④的实验操作;
(4)写出用A与H作电极材料插入G溶液形成闭合电路后的负极反应式是:
。
(5)写出上图中物质C与稀HNO3溶液反应的离子方程式:。
(9分)有一包白色粉末状混合物,可能含有Na2CO3、NaCl、CaCO3、CuSO4、KCl、Na2SO4、MgCl2、KNO3中的某几种,现进行如下实验:
①将混合物溶于水,得到无色透明溶液。
②取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加上稀硝酸,沉淀不溶解,在另一份中加入NaOH溶液,也产生白色沉淀。
根据上述实验现象回答:
(1)原混合物中肯定没有__________________________。
(2)原混合物中肯定有____________________________。
(3)不能确定是否含有____________________________。
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: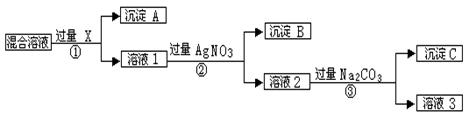
请回答下列问题:
⑴写出实验流程中下列物质的化学式
试剂X :沉淀A:沉淀B:
⑵上述实验流程中加入过量的Na2CO3的目的是。
⑶按此实验方案得到的溶液3中肯定含有(填化学式)杂质。
丁基橡胶可用于制造汽车内胎,合成丁基橡胶的一种单体A的分子式为C4H8,A氢化后得到2—甲基丙烷。完成下列填空:
1)A可以聚合,写出A的两种聚合产物________________、
2)A与某烷发生烷基化反应生成分子式为C8H18的物质B,B的一卤代物只有4种,且碳链不对称。写出B的结构简式_________________。
3)写出将A通入下列两种溶液后出现的现象。
A通入溴水:____________________________
A通入溴的四氯化碳溶液:_________________________
4)烯烃和NBS作用,烯烃中与双键碳相邻碳原子上的一个氢原子被溴原子取代。分子式为C4H8的烃和NBS作用,得到的一溴代烯烃有3种,分别写出其结构简式_______