工业上硝酸的制备和自然界中硝酸的生成既有相同之处,又有区别。路线①②③是工业生产硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径。
(1)写出N2的一种用途 。
(2)实验室制取物质NH3的化学方程式为 。
(3)写出工业制硝酸第③步反应化学方程式 。
(4)硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。 实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(ⅰ)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:___________ 。该反应中发生氧化反应的物质是_______,1 mol氧化剂_________(填“得到”或“失去”)_______ mol电子。
(ⅱ)48.0 g Cu与适量的浓HNO3反应,铜全部溶解后,共收集到标准状况下22.4 L的气体(NO2和NO的混合气体),反应中消耗HNO3的物质的量是( )
| A.1.5 mol | B.2.0 mol | C.2.5 mol | D.3.0 mol |
(ⅲ)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3+ ______  ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O
并配平其对应的离子方程式:□Fe2++□NO3-+□H+ =□Fe3++□N2O↑+□H2O
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是:CO(g)+2H2(g) ⇌CH3OH(g) △H=-90.8 kJ·mol-1
(1)已知:2H2(g)+O2(g)=2H2O △H=-571.6 kJ·mol-1
H2(g)+1/2O2(g)=H2O(g)△H=-241.8 kJ·mol-1
则CH3OH(g)+O2(g)=CO(g)+2H2O(g)的反应热△H= kJ·mol-1。
(2)将1.0molCH4和2.0molH2O(g)通入容积为100L的反应室,在一定条件下发生反应:CH4(g)+ H2O(g)=CO(g)+3H2(g),测得在一定的压强下CH4的转化率与温度的关系如图。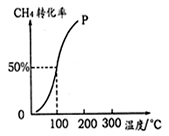
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 。
②100℃时反应的平衡常数为 。
(3)工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸汽重整法。该法中的一个主要反应为CH3OH(g)  CO(g)+2H2(g),此反应能自发进行的原因是 。
CO(g)+2H2(g),此反应能自发进行的原因是 。
②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为 ;在制备H2时最好控制n(O2)/n(CH3OH)= 。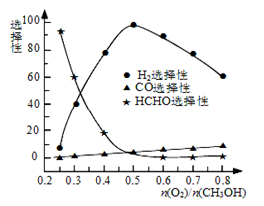
(1)常温下将0.2 mol•L-1 HCl溶液与0.2 mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2 mol•L-1HCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②混合溶液中c(Cl-)-c(M+)= mol•L-1。(填精确计算结果)
(2)常温下若将0.2 mol•L-1 MOH溶液与0.1 mol•L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,若溶液的pH不等于7,则混合溶液的pH 。(填“>7”、“<7”、或“无法确定”)
(4)用0.1000 mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 |
0.1000 mol•L-1 HCl溶液体积/mL |
待测NaOH溶液体积/mL |
| 1 |
27.83 |
20.00 |
| 2 |
25.53 |
20.00 |
| 3 |
27.85 |
20.00 |
①待测NaOH溶液的物质的量浓度为 mol•L-1。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是 。
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.到达滴定终点时,仰视读数
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
已知N2(g)+3H2(g)⇌2NH3(g);△H=﹣Q1 kJ·mol-1(Q1>0),在一个有催化剂的固定容积的容器中加入1molN2和3molH2,在500℃时充分反应,达平衡后NH3的浓度为w mol•L﹣1,放出热量为Q2 kJ.
(1)达到平衡时,N2的转化率为 ;若此时向原容器中通入少量的氩气,N2的转化率将 (填“增大”、“减小”或“不变”)
(2)若在原来的容器中,只加入2mol NH3,500℃时充分反应达平衡后,吸收热量Q3 kJ,则NH3浓度 (填>、=、<)w mol•L﹣1,Q1、Q2、Q3之间满足何种关系 。
(3)下列措施可以同时提高反应速率和H2的转化率是(填选项序号) .
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3d.升高温度
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入1molN2和3 molH2,500℃时充分反应达平衡后,放出热量Q4kJ,则Q2 Q4(填“>”、“<”或“=”).
已知25℃时有关弱电解质的电离平衡常数如下表:
| 弱电解质化学式 |
CH3COOH |
HCN |
H2CO3 |
NH3.H2O |
| 电离平衡常数 |
1.8×l0–5 |
4.9×l0–10 |
K1=4.3×l0–7 K2=5.6×l0–11 |
1.8×l0–5 |
根据上表中数据回答下列问题:
(1)CH3COO-、CN-、CO32-结合质子(即H+)的能力大小顺序__________________;25℃时,有等浓度的①CH3COONa溶液、②NaCN溶液、③NaHCO3溶液,三种溶液的pH由大到小的顺序为 (填序号)。
(2)NaCN溶液中通入少量二氧化碳,反应的离子方程式为
(3)向稀氨水中加入等体积等浓度的醋酸溶液,则反应后溶液中各离子浓度大小关系为
(4)甲、乙两瓶氨水的浓度分别为1mol·L-1、0.1mol·L-1,则c(OH-)甲﹕c(OH-)乙 10(填“>”、“=”或“<”)。
(1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6 kJ热量,写出表示CH4的燃烧热的热化学方程式 。
(2)等物质的量浓度的下列溶液:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH4Fe(SO4)2中 ,c(NH4+)由大到小的顺序为 。
(3)写出符合要求的方程式
①饱和的FeCl3溶液滴入沸水中 (写离子方程式)
②NaHCO3在水溶液中存在的所有电离过程
(4)某温度下的溶液中,c(H+)=10xmol•L-1,c(OH-)=10ymol•L-1。x与y的关系如图所示: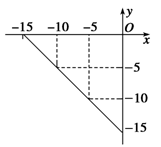
①该温度下,NaCl溶液的pH= 。
②该温度下,pH=8的Ba(OH)2溶液与pH=6的盐酸混合,并保持恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。(忽略溶液混合时体积变化)