CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天
然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。用1 m3(标准状况)的甲烷与水蒸气在高温下反应制取合成气所需的热量为 (保留整数)。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
①计算该反应第一次达平衡时的平衡常数K 。
②3min时改变的反应条件是 (只填一种条件的改变即可)。
(3)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。
①图1中的两条曲线所示投料比的关系X1 X2(填“=”、“>”或“<”下同)。
②图2中两条曲线所示的压强比的关系:P1 P2。
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为 。
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 。
某同学要在一个铁手镯上通过原电池原理覆盖一层银。
①写出该电池的负极反应式:,发生反应,
②正极反应式为:,发生反应。
某有机物A(只含C、H、O)是一种重要化工生产的中间体,其蒸气密度是相同状况下氢气密度的83倍。试根据下列信息回答相关问题:
①A分子中碳原子总数是氧原子总数的3倍,其苯环上只有一个取代基,且取代基碳链上无支链;
②A可与NaHCO3溶液作用,产生无色气泡;
③A在一定条件下可与乙酸发生酯化反应。
请写出:
(1)A的分子式;A的一种可能的结构简式;
A中含氧官能团的名称。
若有机物A存在如下转化关系(见下框图),请据此时A的结构回答(2)、(3)、(4)问: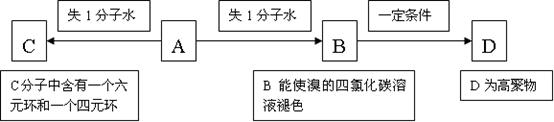
(2)请写出: A→C和B→D的化学反应方程式(注明反应条件),并注明反应类型:
A→C:,反应类型:;
B→D:,反应类型:。
(3)A的一种同分异构体F,其苯环上有两个相邻的取代基,且能与三氯化铁溶液发生显色反应。F在稀硫酸存在下水解生成G和H,其中H俗称“木精”,是饮用假酒过程中致人失明、甚至死亡的元凶。
请写出F的结构简式:。
(4)已知H在一定条件下可被氧化成K,K的水溶液常用作防腐剂,请写出:
H→K的化学方程式:。
甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题: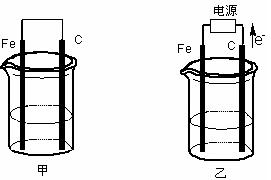
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的棒;乙池中的棒。
②在乙池中阳极的电极反应式是。
(2)若两池中均盛放饱和NaCl溶液。
①写出乙池中发生总反应的离子方程式。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为。
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则溶液混匀后的pH= 。
某种芳香族化合物A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是。
(2)已知:
ⅰ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ. 
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去。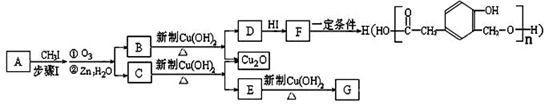 请回答:
请回答:
①步骤Ⅰ的目的是;
②若G的相对分子质量是44,则E的结构简式是;
③ F→H的反应类型是;
④ F在一定条件下可发生分子内酯化反应,生成含七元环结构的M。请写出该反应的化学方程式;
⑤A的结构简式是;
上述转化中B→D的化学方程式是。
(3)已知A的某种同分异构体N具有如下性质:
①N与FeCl3反应,溶液呈紫色;
②N在一定条件下可发生银镜反应,N与H2在苯环侧链上按照物质的量之比1:1作用后的生成物不能发生消去反应;
③在通常情况下,1molN最多能与1molBr2(浓溴水)发生取代反应;
④N分子中苯环上的取代基上无支链且只有三个支链;
N可能的结构有______种,请写出其中一种的结构简式。
(13分) 物质A、E、F的焰色反应呈黄色,物质I的分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示: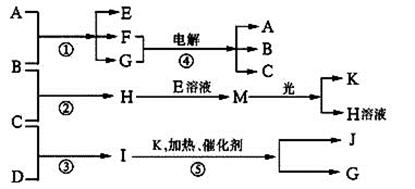
请填写下列空白:
(1)写出下列物质的化学式:B:;J:_________。
(2)写出下列反应的方程式:
反应①的离子方程式: 。
反应⑤的化学方程式:。
(3)在通常状况下,若1 gC气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为:。