【化学——选修2:化学与技术】
某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4;
CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)= 。
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
【2015上海化学】(本题共10分)
对溴苯乙烯与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点。
完成下列填空:
(1)写出该共聚物的结构简式
(2)实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体 。
。
写出该两步反应所需的试剂及条件。
(3)将 与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色。
与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色。
A的结构简式为 。
由上述反应可推知 。
由A生成对溴苯乙烯的反应条件为 。
(4)丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面。
写出B的结构简式。
设计一条由2,3-二甲基-1-丁烯制备B的合成路线。
(合成路线常用的表示方式为: )
)
【2015江苏化学】化合物F是一种抗心肌缺血药物的中间体,可以通过以下方法合成:
(1)化合物A中的含氧官能团为_________和___________(填官能团的名称)。
(2)化合物B的结构简式为________;由C→D的反应类型是:_______。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式_________。
Ⅰ.分子含有2个苯环 Ⅱ.分子中含有3种不同化学环境的氢
(4)已知: ,请写出以
,请写出以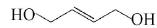 为原料制备化合物X(结构简式
为原料制备化合物X(结构简式 )的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:
)的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:
【2015广东理综化学】有机锌试剂(R—ZnBr)与酰氯(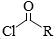 )偶联可用于制备药物Ⅱ:
)偶联可用于制备药物Ⅱ: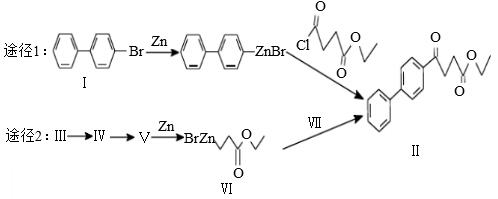
(1)化合物Ⅰ的分子式为 。
(2)关于化合物Ⅱ,下列说法正确的有 (双选)。
| A.可以发生水解反应 |
| B.可与新制的Cu(OH)2共热生成红色沉淀 |
| C.可与FeCl3溶液反应显紫色 |
| D.可与热的浓硝酸和浓硫酸混合液反应 |
(3)化合物Ⅲ含有3个碳原子,且可发生加聚反应,按照途径1合成线路的表示方式,完成途经2中由Ⅲ到Ⅴ的合成路线: (标明反应试剂,忽略反应条件)。
(4)化合物Ⅴ的核磁共振氢谱中峰的组数为 ,以H替代化合物Ⅵ中的ZnBr,所得化合物的羧酸类同分异构体共有 种(不考虑手性异构)。
(5)化合物Ⅵ和Ⅶ反应可直接得到Ⅱ,则化合物Ⅶ的结构简式为: 。
【2015安徽理综化学】四苯基乙烯(TFE)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。以下是TFE的两条合成路线(部分试剂及反应条件省略):
(1)A的名称是______;试剂Y为_____。
(2)B→C的反应类型为_______;B中官能团的名称是______,D中官能团的名称是______.。
(3)E→F的化学方程式是_______________________。
(4)W是D的同分异构体,具有下列结构特征:①属于萘( )的一元取代物;②存在羟甲基(-CH2OH)。写出W所有可能的结构简式:_____。
)的一元取代物;②存在羟甲基(-CH2OH)。写出W所有可能的结构简式:_____。
(5)下列叙述正确的是______。
a.B的酸性比苯酚强b.D不能发生还原反应
c.E含有3种不同化学环境的氢d.TPE既属于芳香烃也属于烯烃
【2015北京理综化学】“张-烯炔环异构反应”被《Name Reactions》收录。该反应可高效构筑五元环化合物:
(R、R‘、R“表示氢、烷基或芳基)
合成五元环有机化合物J的路线如下: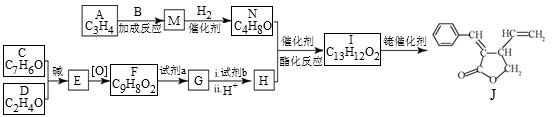
已知: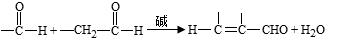
(1)A属于炔烃,其结构简式是 。
(2)B由碳、氢、氧三种元素组成,相对分子质量是30。B的结构简式是 。
(3)C、D含有与B相同的官能团,C是芳香族化合物,E中含有的官能团是 。
(4)F与试剂a反应生成G的化学方程式是 ;试剂b是 。
(5)M和N均为不饱和醇。M的结构简式是 。
(6)N为顺式结构,写出N和H生成I(顺式结构)的化学方程式: 。