A、B、C、D、E、F为前四周期原子序数依次增大的非稀有气体元素。其中:A的一种单质是自然界最硬的物质;B与A同周期且基态原子中s能级与p能级上的电子数相等;C于B同主族;D为同周期电负性最大的元素;E为使用最为广泛的金属;F的基态原子中没有单电子。请回答下列有关问题:
(1)写出E的基态原子的价层电子排布式 ;
(2)AB2的水化物中A的杂化方式为 ,CD2的空间构型为 ;
(3)K3[E(CN)6](此处C为碳元素符号)中配位数为 ,配体的电子式为 ;
(4)某矿石主要成分甲的晶胞如图,甲能与水反应,则甲的化学式为 ,属于 晶体; 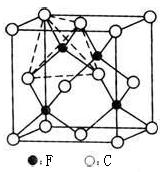
(5)CD2与CB3可以合成广泛用于有机合成的化合物CBD2,同时得到另一种与臭氧互为等电子体的化合物,写出该反应的化学方程式 ;
(6)纳米颗粒E3B4在磁性录像带、磁性存储器、磁性光盘、铁氧体磁芯、波导管和变压器等方面应用广泛,制取该颗粒时,将0.3mol/L ESO4的水溶液和0.4mol/L ECl3的水溶液以体积比2∶1进行混合。根据E3B4的组成分析按此用量混合可能的原因是 。
(12分)根据下图所示的关系,确定A、B、C、D、E、F的化学式,并写有关方程式。
(1)已知A为单质,则A为(填化学式,下同),E为。
(2)D→E的化学方程式为___________________________________。
(3)取少量C溶于水,加入酸化的硝酸银溶液,有白色沉淀生成,则A→C的化学方程式为_____________________________。
(4)某学习小组设计如下装置进行相关实验:
①打开活塞b,向溶液B中逐滴加入少量溴水,关闭活塞b;
②打开活塞a,向容器中滴入足量的亚硫酸。
按要求回答下列问题:
①滴入溴水时,溶液的颜色变为棕黄色,该反应的离子方程式为________。
②滴入亚硫酸时,溶液由棕黄色变为浅绿色,该反应的离子方程式为______。
③由此可知,B中的阳离子、Br-、H2SO3还原性由强到弱的顺序是___________(B中的阳离子用离子符号表示)。
(7分)下图是用废铜料(铁、铜混合物)来生产胆矾(CuSO4·5H2O)的过程,请根据图示回答下列问题。
(1)试剂X是___________(填名称)。
(2)途径Ⅱ的化学方程式为____________________________________。
(3)有关途径Ⅰ和途径Ⅱ的说法正确是___________(填编号)
a.途径Ⅰ的操作步骤比途径Ⅱ多,因此采取途径Ⅱ更合理
b.途径Ⅰ相比途径Ⅱ节省原料,且不产生污染
c.相同质量的单质A完全反应生成硫酸铜的量与途径无关
d.每生成1mol B,消耗1mol氧化剂,转移2mol电子
(4)称取25g胆矾,加热冷却后称量固体的质量减少了7.2g,则所得固体的化学式为___________。
(9分)“三酸两碱”是重要的化工原料,其中的“两碱”为氢氧化钠和碳酸钠。
(1)氢氧化钠不能保存在带玻璃塞的玻璃瓶中的原因是________________________。
(2)实验室配制100mL 1mol/L氢氧化钠溶液时,下列操作会导致浓度偏低的是_____
a.定容时仰视刻度线
b.容量瓶洗涤后没有干燥就直接用于溶液的配制
c.氢氧化钠溶解后没有冷却至室温,就将溶液转移到容量瓶中
d.定容摇匀后,发现液面低于刻度线,又加水使液面与刻度线相平
(3)将足量二氧化碳通入氢氧化钠溶液中的离子方程式为_________________。
(4)向碳酸钠溶液中逐滴加入稀盐酸至过量,碳酸氢根离子浓度变化趋势是_______;碳酸钠溶液中混有少量碳酸氢钠,可用氢氧化钠来除杂,反应的离子方程式为_______。
(6分)下表为各物质中所含有的少量杂质,在空格处填写除杂所用试剂和操作方法。
| 序号 |
物质 |
杂质 |
除杂质试剂 |
操作方法 |
| ① |
Fe(OH)3胶体[ |
Na+、Cl- |
水 |
|
| ② |
FeSO4溶液 |
CuSO4 |
||
| ③ |
CO2 |
HCl |
洗气 |
|
| ④ |
NaCl溶液 |
I2 |
(10分)甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO(g)+ 2H2(g) CH3OH (g)
CH3OH (g)
(1)下图表示反应中能量的变化。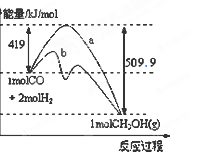
①此反应的ΔH=___________。
②已知CO2(g)+H2(g) CO(g)+H2O(g) △H=" +" 41.3kJ·mol-1,试写出由CO2和H2制取甲醇的热化学方程式。
CO(g)+H2O(g) △H=" +" 41.3kJ·mol-1,试写出由CO2和H2制取甲醇的热化学方程式。
(2)一种新型燃料电池,是用两根金属铂做电极插入KOH溶液中,然后向两极上分别通入CH3OH和O2。装置图如下所示: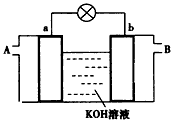
①经测定,电子流动方向由b到a,则甲醇从_______(填“A”或“B”)口通入,该极的电极反应式为___________________。
②该电池工作一段时间后,正极附近的碱性____(填“增强”、“减弱”或“不变”)。
③用该电池电解(惰性电极)硝酸银溶液时,每消耗32 g CH3OH,生成银的质量为___ g。