如图A、B两种固体物质的溶解度曲线.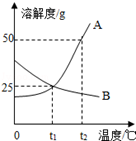
(1)t1℃时A、B两物质的溶解度为 g.
(2)使一定量接近饱和的A物质溶液变为饱和溶液采用的一种方法是____________
(3)t1℃时,将一定量B的饱和溶液升温至t2℃,溶质的质量将______ (填“增加”、“减少”或“不变”).
(4)t2℃时,将等质量的A、B两种物质分别加水溶解,配制成其饱和溶液,所得溶液质量的大小关系为: A B(填“>”“=”或“<”).
二百多年前,法国化学家拉瓦锡通过实验得出了空气是由__________和__________组成的,其中__________约占空气总体积的1/5,__________约占空气总体积的4/5。
研究性学习小组选择下列某些仪器制取气体。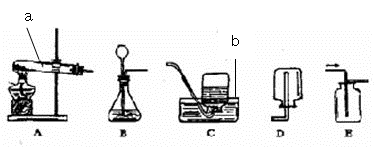
(1)写出仪器名称ab
(2)该小组同学用加热高锰酸钾的方法制取氧气。写出该反应的文字或符号表达式:___________ _______,此时发生装置应该选用上图中的________,收集氧气的装置可以用________。
(3)A装置中试管口略向下倾斜的原因是。
(4)实验结束,先___________ ,再______________,防止水槽中的水倒流使试管破裂。
(5)若分解过氧化氢制取氧气,供选用的装置如右图:要得到平稳的氧气流,应选用的发生装置是(选填“甲”或“乙”);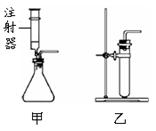
(6)实验室常用硫化亚铁固体与稀硫酸在常温下反应制硫化氢气体和硫酸亚铁。硫化氢气体是无色有刺激性气味的有毒气体,它的密度比空气大,能溶于水。由此可推知:实验室制取硫化氢气体时,装置的组合应选用上图所示的(填代号)装置。
(7)世界首个模拟火星之旅“火星—500”全封闭试验,与2010年6月3日在俄罗斯启动,6名来自俄罗斯、中国、法国等国的志愿者将在模拟密封舱内生活520个日夜。看到相关报告后,某化学兴趣小组,开展了模拟“为志愿者在密封舱内生活设计供氧方案”活动。并设计了如下方案:(1)加热高锰酸钾;(2)电解水;(3)过氧化钠+二氧化碳→碳酸钠+氧气 你认为,最适合于在模拟密封舱内制氧气的方案是(填序号);与其他方法相比;这种方法的优点是
如图是制取蒸馏水的简易装置,在试管a中加入约1/3容积的水和几片碎瓷片。将长玻璃导管c一端插入洁净的试管b中,导管c末端距离试管b底部2cm~3cm。把试管b放入盛有冷水的烧杯d里。用酒精灯加热试管a中的水,加热至试管b里有蒸馏水生成。回答下列问题:
(1)烧杯d中冷水的作用是____________;
(2)加热a试管时,常加入几片碎瓷片的目的是_______________________________;
(3)为什么要使用很长的一段玻璃导管c__________________________;
(4)用分子、原子的知识解释制取蒸馏水与水电解过程的不同___________________________。
元素周期表是化学学习和研究的重要工具。下图是元素周期表的一部分。
| 1 H 1.008 |
2 He 4.003 |
|||||||
| 3 Li 6.941 |
4 Be 9.012 |
… |
5 B 10.81 |
6 C 12.01 |
7 N 14.01 |
8 O 16.00 |
9 F 19.00 |
10 Ne 20.18 |
| 11 Na 22.99 |
12 Mg 24.31 |
13 Al 26.98 |
14 Si 28.09 |
15 P 30.97 |
16 S 32.06 |
17 Cl 35.45 |
18 Ar 39.95 |
⑴相对原子质量为30.97的元素属(填“金属”或“非金属”)。
⑵科学家宣布,现已人工合成了第120号元素,则此元素的核电荷数为。
⑶与氟元素化学性质相似的元素是(填元素名称)。
⑷地壳中含量最多的金属元素与空气中含量最多和第二的元素形成化合物化学式
⑸表中不同种元素最本质的区别是(填字母)
A.质子数不同 B.相对原子质量不同 C.中子数不同
下图为某同学进行电解水实验的装置图,据此回答: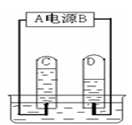
⑴图中A端为电源的___(填“正”或“负”)极。
⑵C试管中收集到的气体是____,C、D试管中收集到的气体的体积比约为____。
⑶上述实验可以得出:水是由_________________组成的。
⑷在水的电解实验中,在变化前后没有改变的微粒是________。
⑸世博园区内有许多饮水台,可取水直接饮用。其中的饮用水处理步骤如下图所示;
步骤①对应的作用是(填字母.下同),步骤③对应的作用是。
A杀菌消毒 B吸附杂质
⑹保护水资源,防止水污染是每个公民和全社会的责任.下列做法有利于防止水资源污染的是 _____________①农业生产中要合理使用农药和化肥②工业废水和生活污水处理达标后再排放③不用含磷洗衣粉 ④将海水淡化
A.①②④ B. ②③④ C.①②③ D. ①②③④