在恒温恒容的密闭容器中加入1molX和2molY,发生反应:X(g)+2Y(g)  2Z(g), 该反应达到平衡的标志是
2Z(g), 该反应达到平衡的标志是
| A.混合气体的密度不再随时间变化 |
| B.容器内X、Y、Z的浓度之比为:1:2:2 |
| C.单位时间消耗0.1molX,同时生成0.2molY |
| D.单位时间消耗0.1molX,同时生成0.2molZ |
下列A、B、C、D四种分离物质的方法,从其分离的原理来看,有一种与其他三种不同。这种方法是( )
A.用蒸发水分的方法使海水中的盐析出
B.用加热蒸馏的方法,从发酵后的物质中把酒精分离出来
C.用加热升华的方法把单质碘从它和碘化钾固体形成的混合物中分离出来
D.用加热的方法,把掺杂在NaCl固体中的少量NH4HCO3固体除去
要对热稳定的高沸点液态有机物和低沸点的杂质的混合物进行提纯一般操作是( )
| A.蒸馏 | B.重结晶 | C.过滤 | D.萃取 |
下列各项操作,有错误的是( )
| A.用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 |
| B.进行分液时,分液漏斗中的下层液体,从下端流出,上层液体则从上口倒出 |
| C.萃取、分液前需对分液漏斗检漏 |
| D.为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下 |
下列属于分离、提纯固态有机物的操作的是( )
| A.蒸馏 | B.萃取 | C.重结晶 | D.分液 |
给下列苯的同系物命名。
(1)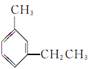 的系统名称为________________________。
的系统名称为________________________。
(2)  的系统名称为___________________________。
的系统名称为___________________________。