向一定量Fe、FeO和Fe2O3的混合物中,加入120 mL 4 mol·L 的稀硝酸,恰好使混合物完
的稀硝酸,恰好使混合物完
全溶解,放出1.344 L(标准状况)气体,往所得溶液中加入KMnO4的酸性溶液,无明显现象,
若用足量的H2在加热条件下还原相同质量的混合物,能得到铁的物质的量为
| A.0.21 mol | B.0.14 mol | C.0.16 mol | D.0.24 mol |
常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
| 实验编号 |
c(HA)/mol·L-1 |
c(NaOH)/mol·L-1 |
混合溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.2 |
0.2 |
pH=9 |
| 丙 |
c1 |
0.2 |
pH=7 |
| 丁 |
0.2 |
0.1 |
pH<7 |
下列判断正确的是
A.a>9
B.在乙组混合液中由水电离出的c(OH-)=10-5mol·L-1
C.c1<0.2
D.丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-)
常温下,0.1 mol·L-1某一元酸HA溶液中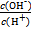 =1×10-12,下列说法中正确的是
=1×10-12,下列说法中正确的是
| A.溶液中由水电离出的c(H+)=1×10-10 mol·L-1 |
B.溶液中存在HA H++A- H++A- |
| C.与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性 |
| D.原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 |
常温下现有的四份溶液:
①0.01 mol/L HCl;②0.01 mol/L CH3COOH;③pH=12 的氨水;④pH=12的NaOH溶液。
下列说法正确的是
| A.②中由水电离出的c(H+)=1×10-12mol/L |
| B.将①、③混合,若有pH=7,则消耗溶液的体积:③>① |
| C.将②、④等体积混合(体积变化忽略不计),则c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
| D.将四份溶液均稀释10倍后溶液pH:③>④,②<① |
下列有关元素的性质及其递变规律正确的是
| A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| B.第二周期元素从左到右,最高正价从+1递增到+7 |
| C.同主族元素的简单阴离子还原性越强,水解程度越大 |
| D.同周期金属元素的化合价越高,其原子失电子能力越强 |
目前人类已发现的非金属元素除稀有气体外共有16种,对这16种非金属元素的相关判断( )
①都是主族元素,最外层电子数都大于4
②单质在反应中都只能作氧化剂
③氢化物常温下都是气态,所以又叫作气态氢化物
④氧化物常温下都可以与水反应生成酸
⑤根据非金属原子最外层的电子数,可判断两种元素得电子能力的强弱
⑥非金属得电子后形成的简单阴离子的核外电子排布一定与上一周期稀有气体原子的核外电子排布相同
| A.④⑤正确 | B.①③⑥正确 |
| C.②③⑤正确 | D.都错误 |