(16分)某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2·6C2H5OH。
(1)制备乙酸乙酯装置如图所示,虚框内玻璃仪器名称为 ;

(2)生成乙酸乙酯的化学反应方程式为 ;浓硫酸的作用是 ;
(3)冷凝水流经冷凝管时应从 口进入(填“a”或“b”);
(4)下列措施可提高乙酸的转化率可采取的有( )
A.增加乙醇的用量 B.蒸出乙酸乙酯
C.增加乙酸的用量 D.冷凝管中通热水
(5)实验所得乙酸乙酯远低于理论产量的可能原因 。(写出其中两种)
(6)为了除去粗产品其中的醋酸,可向产品中加入 溶液,在分液漏斗中充分振荡, 然后静置,待分层后 (填选项)。
A.直接将有机层从分液漏斗上口倒出
B.直接将有机层从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将有机层从下口放出
D.先将水层从分液漏斗的下口放出,再将有机层从上口倒出
(7)再向得到的有机物粗产品中加入饱和氯化钙溶液,振荡、分离。加入饱和氯化钙溶液的目的是 。
(8)最后,加入干燥剂除去其中的水分,再进行 (填操作),即可得到纯净的乙酸乙酯。
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ 反应产物的定性探究
实验装置如图所示。(固定装置已略去)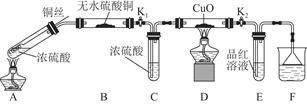
(1)A中反应的化学方程式为。
(2)F烧杯中的溶液通常是。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
| 硫酸/mol·L-1 |
黑色物质出现的温度/℃ |
黑色物质消失的温度/℃ |
| 15 |
约150 |
约236 |
| 16 |
约140 |
约250 |
| 18 |
约120 |
不消失 |
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的正确结论是__。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol·L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为_。(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
乙醇在一定条件下可被氧化,某同学利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。已知乙醛在加热条件下能与新制Cu(OH)2悬浊液反应生成Cu2O。(代表酒精灯)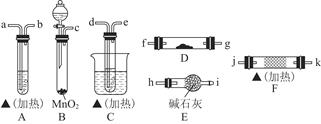
回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为__(填仪器接口的字母编号)(加热和夹持装置已略去)。
(2)B装置的分液漏斗中液体药品是_(填化学式)。该液体还可以与酸性KMnO4溶液反应产生相同的气体,写出该反应的离子方程式。
(3)F装置中的固体试剂是,发生反应的化学方程式为。反应一段时间后移去酒精灯,反应能继续进行,其原因是。
(4)A装置和D装置中的实验现象分别为、。
(5)为了提高乙醇的转化率,可以对C装置进行改进,提出你的改进意见。
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g)NH2COONH4(s) ΔH<0。
(1)如图所示装置制取氨气,你所选择的试剂是________________________。
(2)制备氨基甲酸铵的装置如图13-7所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。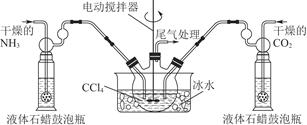
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是________________________________________________________________________________________________________________________________________________。
液体石蜡鼓泡瓶的作用是________________________________________________________________________。
②从反应后的混合物中分离出产品的实验方法是________________________________________________________________________
(填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40 ℃以下烘干
③尾气处理装置如图所示。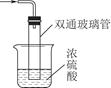
双通玻璃管的作用:____________;浓硫酸的作用:______________________、__________________________________________________________________。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173 0 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500 g。则样品中氨基甲酸铵的物质的量分数为________。[Mr(NH2COONH4)=78,Mr(NH4HCO3)=79,Mr(CaCO3)=100]
某课外活动小组的同学,研究用过量的锌与浓硫酸反应制取二氧化硫的有关问题:
(1)锌与浓硫酸反应制取二氧化硫的化学方程式为______________________________。
(2)这样制取的二氧化硫气体中可能含有的杂质是__________________;原因是________________________________________________________________________________________________________________________________________________。
(3)某同学用下列装置连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是________(用a、b……填写)。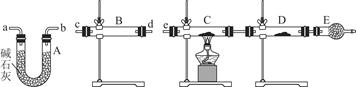
(4)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下表:
| 装置 |
所盛药品 |
实验现象 |
结论或解释 |
| B |
|||
| C |
CuO固体 |
某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如图所示装置: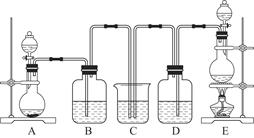
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的特质有________________。
(2)反应开始后,发现B、D两个集气瓶中的品红溶液都褪色,停止通气后,用热水浴给B、D两个集气瓶加热。两个集气瓶中的现象分别为:B____________________;D____________________。
(3)装置C的作用是______________________________________________________。
(4)该实验小组的甲、乙两位同学利用上述两个发生装置按图所示装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。
试根据该实验装置和两名同学的实验结果回答问题:
①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸中的目的:________________________________________________________________________________________________________________________________________________。
②试分析甲同学实验过程中,品红溶液不褪色的原因是____________________________________________________________________________________________________________________________________________________________________________________________________________________。(结合离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?
________________________________________________________________________。