解释下列相应的实验事实方程式正确的是
| A.稀硫酸与氢氧化钡溶液恰好中和:Ba2++OH-+H+十SO42-= BaSO4↓+H2O |
B.测得0.1 mol/L氨水中C(OH-)为10-3 mol/L:NH3·H2O NH4++OH- NH4++OH- |
| C.在偏铝酸钠溶液中通入过量CO2出现白色沉淀:2AlO2-+ CO2 + 3H2O = 2Al(OH)3↓ + CO32- |
| D.碳酸氢钠溶液与过量石灰水混合出现白色沉淀:2HCO3-+ Ca2+ + 2OH- = CaCO3↓+ CO32-+2H2O |
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:
2Fe(OH)3+3Cl2+10KOH2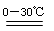 K2FeO4+KCl+8H2O
K2FeO4+KCl+8H2O
对于该反应,下列说法正确的是
| A.该反应是置换反应 | B.钾元素化合价降低 |
| C.Fe(OH)3发生还原反应 | D.Cl2是氧化剂 |
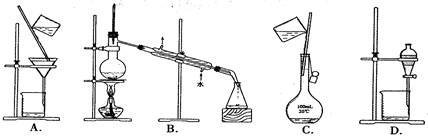
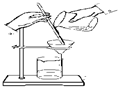
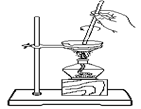
下列实验操作正确的是
 |
 |
 |
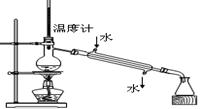 |
| A.称量氢氧化钠固体 |
B.分离柴油和水 |
C.把饱和食盐水中的食盐提取出来 |
D.分离两种互溶但沸点相差较大的液体混合物 |
下列反应中属于氧化还原反应的离子方程式的是
| A.CaCO3+2H+=Ca2++CO2↑+H2O | B.2Fe2++Cl2=2Fe3++2Cl- |
| C.HCO3-+H+=CO2+H2O | D.Na2O+H2O=2Na++2OH- |
在盛有碘水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象,则加入的试剂分别是
| A.①是酒精,②是CCl4,③是苯 |
| B.①是苯,②是CCl4,③是酒精 |
| C.①是CCl4,②是苯,③是酒精 |
| D.①是苯,②是酒精,③是CCl4 |
下列实验操作中,不能用于物质分离的是