可以证明某化合物一定含有离子键的性质是
| A.熔融状态能导电 | B.具有较高的熔点 |
| C.可溶于水 | D.溶于水能导电 |
吸热反应一定是()
| A.释放能量 |
| B.储存能量 |
| C.反应物的总能量低于生成物的总能量 |
| D.反应物的总能量高于生成物的总能量 |
下列说法正确的是()
| A.物质发生化学反应都伴随着能量变化 |
| B.伴随着能量变化的物质变化都是化学变化 |
| C.在一个确定的化学反应关系中,反应物的总能量与生成物的总内能量一定不同 |
| D.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
把 和NO的混合气体40ml。,缓缓通人盛足量
和NO的混合气体40ml。,缓缓通人盛足量 的装置后,体积缩小到20mL,则混合气体中
的装置后,体积缩小到20mL,则混合气体中 和NO的体积比不可能是
和NO的体积比不可能是
| A.1:2 | B.3:4 | C.3:2 | D.5:4 |
已知 显酸性,
显酸性, 溶液显碱性,现有浓度为0.1mol/L的
溶液显碱性,现有浓度为0.1mol/L的 和
和 两种溶液,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的一组是
两种溶液,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的一组是
A.
B.
C.
D.
某恒温、恒容的容器中,建立如下平衡: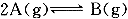 ,在相同条件下,若分别再向容器中通人一定量的A气体或B气体,重新达到平衡后,容器内A和B的体积分数比平衡时
,在相同条件下,若分别再向容器中通人一定量的A气体或B气体,重新达到平衡后,容器内A和B的体积分数比平衡时
| A.都增大 | B.都减少 |
| C.前者增大,后者减少 | D.前者减少,后者增大 |