下面关于Na2CO3和NaHCO3性质的叙述,正确的是
| A.受热时NaHCO3比Na2CO3稳定 |
| B.在水中NaHCO3比Na2CO3溶解性大 |
| C.质量相等的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3放出的CO2比Na2CO3多 |
| D.物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应,放出CO2的物质的量之比为2:1 |
在甲苯中,加入少量酸性高锰酸钾溶液,振荡后溶液褪色,下列解释正确的是
| A.甲基受苯环的影响而易被氧化 |
| B.苯环被KMnO4所氧化而破坏 |
| C.甲苯中碳原子数比苯分子中原子数多 |
| D.苯环和侧链相互影响,同时被氧化 |
有机化学在日常生活应用广泛,下列有关说法不正确的是
| A.相同条件下,正丁烷、新戊烷、异戊烷的沸点依次增大 |
| B.苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 |
| C.甲苯和Cl2光照下的反应与乙醇和乙酸的反应属于同一类型的反应 |
| D.有芳香气味的C9H18O2在酸性条件下加热可水解产生相对分子质量相同的两种有机物,则符合此条件的C9H18O2的结构有16种 |
下列关于芳香烃的叙述中不正确的是
| A.乙烷和甲苯中都含有甲基,甲苯可以被酸性KMnO4溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响。 |
| B.苯和浓硝酸、浓硫酸混合物在100—1100C才能生成二硝基苯,而甲苯在1000 C时即可生成三硝基甲苯,说明甲基对苯环产生了影响。 |
| C.甲苯、苯乙烯、萘、硝基苯均属于芳香烃,其工业上主要来源为石油和煤。 |
| D.除去苯中混入的少量甲苯可加入适量的酸性KMnO4溶液,充分反应后再加入足量的NaOH溶液,然后分液即可。 |
维生素A1、B2的结构简式分别如图所示: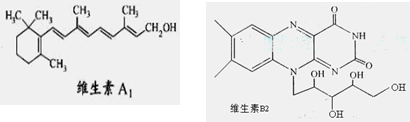
已知:
下列说法正确的是
| A.1mol维生素A1最多与溴水中的4molBr2发生加成反应 |
| B.维生素A1的分子式为C19H30O,是一种易溶于水的高分子。 |
| C.维生素B2在酸性条件下彻底水解后得到的有机物,其分子内发生酯化得多种酯 |
| D.用-C4H9取代维生素B2苯环上的一个H原子,最多可得4种同分异构体 |
下列是三种有机物的结构简式
下列说法正确的是
| A.三种有机物都能发生水解反应 |
| B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 |
| C.三种物质中,其中有两种互为同分异构体 |
| D.三种物质在一定条件下,均可以与H2发生加成反应 |