【化学-选修3 物质结构与性质】
铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置 。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于______(填晶体类型).Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x="______" 。Fe(CO)x在一定条件下发生反应:Fe(CO)x(s) Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有 、 。
Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有 、 。
(3)k3[Fe(CN)6]溶液可用于检验 (填离子符号)。CN-中碳原子杂化轨道类型为 ,C、N、O三元素的第一电离能由大到小的顺序为 (用元素符号表示)。
(4)铜晶体铜碳原子的堆积方式如图所示。
①基态铜原子的核外电子排布式为 。
②每个铜原子周围距离最近的铜原子数目 。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑点代表铜原子)。
①该晶体的化学式为 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 (填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏伽德罗常数为NA,
则该晶体中铜原子和M原子之间的最短距离为 pm(只写计算式)。
(1)+3价Co的配合物CoClm·nNH3,中心原子的配位数为6,若1 mol该配合物与足量AgNO3溶液反应生成1 mol AgCl沉淀,用配合物形式写出该配合物的化学式。
(2)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大磁记录性能越好。离子型氧化物MnO2和Fe3O4及Cr2O3中,磁性最大的是___________。
(3)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨(如下左图),每个碳原子通过 杂化与周围碳原子成键。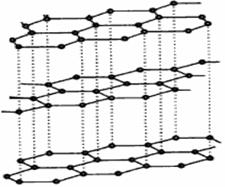
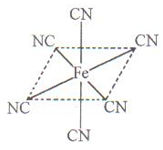
(4)铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如上右图。
①已知CN—与N2结构相似,1molCN-中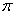 键数目为。
键数目为。
②上述沉淀溶解过程的化学方程式为。
第四周期元素的单质及化合物在工农业生产中应用广泛。
(1)第四周期元素中,基态原子的最外层只有1个电子的元素共有种。
(2)铂丝蘸取氯化钙在酒精灯上灼烧,火焰呈现砖红色,显色原因是(填序号)。
| A.氯化钙受热挥发 | B.氯化钙受热分解 |
| C.钙离子中电子跃迁 | D.氯离子中电子跃迁 |
(3)无水硫酸铜呈白色,吸水后形成胆矾,呈蓝色。科学家通过X射线测定出胆矾的结构,其结构可用右图表示。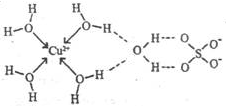
①胆矾晶体中除共价键、配位键及微弱的范德华力外,还存在的两种作用力是和。
②胆矾晶体CuSO4·5H2O可以写出[Cu(H2O)4]SO4·H2O,其中中心原子(离子)是,配体是,配位原子是,配位数是。
③铜离子形成胆矾中配位离子的离子方程式为。
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如右表。据表判断Mn2+和Fe2+再失去-个电子的难易,并从原子结构的角度筒述其原因。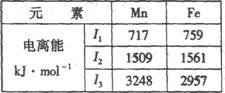
已知与碳元素同主族的X元素位于周期表中的第1个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们所形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为。
(2)若X、Y两元素电负性分别为2.1和2.85,则XY4中X与Y之间的化学键为(填“共价键”或“离子键”)。
(3)XY4的立体构型为,该化合物分子为(填“极性分子”或“非极性分子”)。
(4)XY4在常温下为液体,该化合物中存在的微粒间作用力有。
(5)XY4的沸点与SiCl4比较,(填化学式)的高,原因是。
已知:核电荷数小于18的三种元素X、Y、Z;X原子最外能层的p能级中有一个轨道填充了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的价电子排布式为,Y的轨道表示式为。
(2)ZX2的分子构型为,YX2的电子式为。
(3)Y与Z形成的化合物中化学键是______键(填“极性”或“非极性”,下同),该分子属于__________分子。
(4)X的最简单氢化物中键角为,Y的最简单氢化物中中心原子是______杂化。
下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
| a |
|||||||||||||||||
| b |
c |
d |
e |
||||||||||||||
| f |
g |
||||||||||||||||
| d |
h |
[ |
|||||||||||||||
(1)请写出上述元素h的基态原子核外电子排布式;
(2)比较e、g两种元素的气态氢化物的稳定性(写化学式);
(3)b2a4分子的结构式是,该分子中存在的σ键与π键的个数比为;
(4)c、d两种元素中第一电离能较大的是(写元素符号),其原因是;
(5)已知f的氢氧化物与水电离出的OH—可形成配位键,则生成的含有配位键的离子的结构简式为(标出配位键)。