【化学-选修3物质结构与性质】(15分)早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区别晶体、准晶体和非晶体。
(2)基态Fe原子有_______个未成对电子,Fe3+的电子排布式为_________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为____________。
(3)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道为___________,1mol乙醛分子中含有的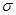 键的数目为___________。乙酸的沸点明显高于乙醛,其主要原因是___________ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和定点,则该晶胞中有 个铜原子。
键的数目为___________。乙酸的沸点明显高于乙醛,其主要原因是___________ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和定点,则该晶胞中有 个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数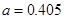 nm,晶胞中铝原子的配位数为 。列式表示Al单质的密度 g
nm,晶胞中铝原子的配位数为 。列式表示Al单质的密度 g cm-3。
cm-3。
有以下物质:①液氨;②氨水;③盐酸;④醋酸;⑤硫酸钡;⑥银;⑦氯化钠晶体;⑧二氧化碳;⑨醋酸铵;⑩酒精溶液。
(1)属于电解质的是_____________________________________________________________;
(2)能导电的是_________________________________________________________________;
(3)属于强电解质的是___________________________________________________________。
取少量Fe2O3粉末(红棕色)加入适量盐酸,所发生反应的化学方程式为_________,反应后得到的FeCl3溶液呈黄色。用此溶液进行以下实验:
(1)取少量溶液置于试管中,滴入NaOH溶液,可以观察到有红褐色沉淀生成,反应的化学方程式为________________________________________________,
此反应属于_________反应。
(2)在小烧杯中加入25 mL蒸馏水,加热至沸腾后,向沸水中加入2 mL FeCl3溶液,继续煮沸至溶液呈________色,即可制得Fe(OH)3胶体。
(3)另取一小烧杯也加入25 mL蒸馏水,向烧杯中也加入2 mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置暗处:分别用红色激光笔照射烧杯中的液体,在与光线垂直的角度,可以看到________烧杯中会产生丁达尔效应。用这个实验可以区别________________________________________________________________________。
(4)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀盐酸,边滴边振荡,可以看到溶液红褐色逐渐变浅,最终又得到了黄色的FeCl3溶液,发生此变化的化学方程式为___________________________,此反应属于_________反应。
实验室里常用的干燥剂有:①浓硫酸(98%),②无水氯化钙,③变色硅胶[硅胶的主要成分是二氧化硅,在其中掺入少量的无水氯化钴(CoCl2)作指示剂,无水氯化钴呈蓝色,吸水后变为CoCl2·6H2O呈粉红色],④五氧化二磷,⑤碱石灰(主要成分是氢氧化钠、氧化钙,制法是:把生石灰加到浓的烧碱溶液中,再加强热蒸干)等。
(1)写出制取干燥剂碱石灰过程中有关反应的化学方程式:__________________________________。
(2)上述物质中,属于纯净物的是______。
| A.①②④ | B.②④ |
| C.①②④⑤ | D.全部 |
(3)上述干燥剂中,不宜用于干燥氯化氢气体的是______。
(4)上述①~④,其主要化学成分依次属于______、______、______、______ (填写各物质所属的类别)。
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
| 溶质的物质的量 浓度/mol·L-1 |
溶液的密度 /g·cm-3 |
|
| 硫酸 |
c1 |
ρ1 |
| 氨水 |
c2 |
ρ2 |
(1)表中硫酸的质量分数为_____(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为_____mol·L-1。
(3)物质的量浓度为c2 mol·L-1的氨水与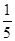 c2 mol·L-1的氨水等质量混合,所得溶液的密度_____ (填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度_____
c2 mol·L-1的氨水等质量混合,所得溶液的密度_____ (填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度_____ c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶某品牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25% NaClO、1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为_____mol·L-1。
(2)该同学取100 mL该品牌“84消毒液”稀释后用于消毒,稀释后的溶液中
c(Na+)≈_____mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)该同学参阅该品牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是_____。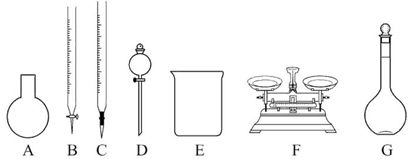
| A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制 |
| C.利用购买的商品NaClO来配制可能导致结果偏低 |
| D.需要称量的NaClO固体质量为143 g |