某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)滴定:①用 式滴定管盛装camol/L盐酸标准液。右图
表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的
标准盐酸的体积填入③表空格中。滴定管中剩余液体的体积
25.10mL(填大于、小于或者等于)。
②下表是3种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
酚酞 |
| 变色范围(pH) |
5.0—8.0 |
3.1—4.4 |
8.2—10.0 |
该实验可选用 作指示剂;
③有关数据记录如下:
| 滴定序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
||
| 滴定前 |
滴定后 |
消耗的体积 |
||
| 1 |
V |
0.50 |
25.12 |
24.62 |
| 2 |
 V V |
|
|
|
| 3 |
V |
6.00 |
30.58 |
24.58 |
(2)根据所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)
cb= 。
(3)下列几种情况会使测定结果偏高的是
a.若滴定前用蒸馏水冲洗锥形瓶;
b.读数时,若滴定前仰视,滴定后俯视;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外;
d.若未充分振荡,刚看到溶液变色,立刻停止滴定。
(8分) 元素及其化合物的知识是高中化学重要的组成部分,是考查化学基本概念和理论、化学计算、化学实验知识的载体。
(1)元素周期表1-20号元素中,某两种元素的原子序数相差3,周期数相差1。
①这样的两种元素的组合有________种。
②若这样的两种元素形成的化合物中原子数之比为1∶1。
写出其中一种化合物的名称:____________________________;
(2)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由下图表示: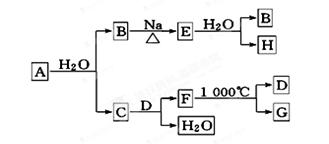
请回答下列问题:
①F的化学式为________,D的电子式为________________
②E与水反应的化学方程式为________________________________;
③实际生产中,可由F为原料制备单质A,写出制备过程的化学方程式(不需考虑综合经济效益)
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最多的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E原子的核外电子排布式为,A、B、C、D的第一电离能最小的是
(2)B的氧化物的熔点远高于D的氧化物的熔点,理由是
(3)A的最高价含氧酸根离子中,其中心原子是杂化,D的低价氧化物的空间构型为
(4)A、C形成某种化合物的晶胞结构如右图所示,则其化学式为
(5)E单质的晶体的晶胞结构如下图。若E原子的半径是r cm,则E单质的密度的计算公式是(用NA表示阿伏伽德罗常数)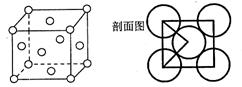
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)  2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:
| 温度/℃ |
1538 |
1760 |
2404 |
| 平衡常数K |
0.86×10-4 |
2.6×10-4 |
64×10-4 |
该反应的△H0。(填“>”、“=”或“<”)
(3)一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率, 可以采取的措施是。
A.降低温度B.加催化剂
C.增加压强D.增加O2浓度
E.分离出一氧化氮
(4)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应:
N2(g)+O2(g)  2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应,计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应,计算结果保留两位有效数字)
(5) NO在科学界被誉为“明星分子”, 用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂。已知 火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气)。
且:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
请写出肼与NO2反应的热化学方程式_______________________________________________
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:
(1)甲池为(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为。
(2)丙池中F电极为(填“正极”、“负极”、“阴极”或“阳极”),该池总反应的化学方程式为。
(3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为mL(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是(填选项字母)。
| A.Cu | B.CuO | C.Cu(OH)2 | D.Cu2(OH)2CO3 |
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据图1提供的信息,写出该反应的热化学方程式,
在图1中曲线(填“a” 或“b”)表示加入铁触媒的能量变化曲线。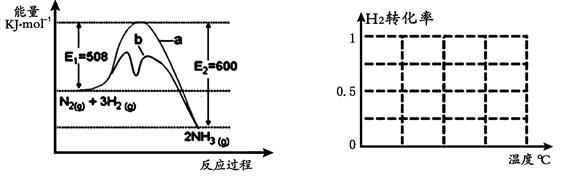
图1图2
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3v(H2)正=2v(NH3)逆 B.单位时间内生成nmolN2的同时生成2nmolNH3
C.混合气体的密度不再改变 D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)=,该温度下的平衡常数K=。若升高温度,K值变化(填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 |
T(℃) |
n (N2)/n(H2) |
P(MPa) |
| ⅰ |
450 |
1/3 |
1 |
| ⅱ |
_ |
_ |
10 |
| ⅲ |
480 |
_ |
10 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应N2+3H2 2NH3的特点,在给出的坐标图2中,画出其在1MPa和10MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
2NH3的特点,在给出的坐标图2中,画出其在1MPa和10MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。