煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)===CO2(g) ΔH=E1 ①
b.C(s)+H2O(g)===CO(g)+H2(g) ΔH=E2 ②
H2(g)+O2(g)===H2O(g) ΔH=E3 ③
CO(g)+O2(g)===CO2( g) ΔH=E4 ④
g) ΔH=E4 ④
回答:
(1)上述 四个热化学方程式中的哪些反应ΔH<0?(填序号)
四个热化学方程式中的哪些反应ΔH<0?(填序号)
____________________________________________________________________。
(2)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是( )
A.a比b多  B.a比b少 C.a与b在理论上相同
B.a比b少 C.a与b在理论上相同
(3)根据能量守恒定律,E1、E2、E3、E4之间的关系为
__________________________________________________________________。
在密闭容器中进行如下反应:3m A(g)+m B(g) n C(g)+q D(s)。
n C(g)+q D(s)。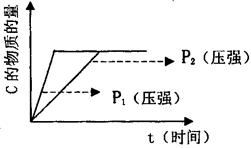
(一)
(1)若在起始容积相等的两个体积可变的容器中,充入物质的量相等的反应物(反应过程中保持体系的温度不变),建立如图所示的平衡,则由图可知:P1P2(填“>”、“<”或“=”);m与n之间的关系为:(用含m的代数式表示n)。
(2)对(1)的反应而言,下列能够判断反应已达化学平衡状态的有。
A.气体总的物质的量不变 B.固体D的物质的量一定
C.气体的密度不变 D.当气体A与B的物质的量之比为3:1时
E.气体A的浓度不变 F.反应速率v (A)=3m/nv(C)
(3)在一定的温度和压强下,将3moIA和1moIB充入体积可变的容器,达到平衡时,B的物质的量浓度为amol/L.现持续增大压强,有:
①当压强为平衡时的2.5倍时,B平衡时的物质的量浓度为C1 mol/L,测得C1=-2.5a;
②当压强为平衡时的10倍时, B平衡时的物质的量浓度为C2mol/L,测得C2= 5.5a;
试分析造成第②种结果的可能原因:。
(二)若m=n=q,且保持原容器的体积不变,在一定温度下,将3molA和1mnolB充入该容器中,平衡时容器中B的转化率为W%。
(4)若在体积和温度不变的条件下,仅从生成物开始配料,要达到上述等数,则D的起始物质的量n(D)应满足的条件是____(用含有W%的代数式表示,下同),平衡时C的转化率为。
工业上制各硝酸的第一步反应是
4NH3+5O2 4NO+6H2O
4NO+6H2O
某化学课外小组设计了如图所示的实验装置,模拟进行该实验。图中箭头表示气体流向。A表示一种纯净、干燥的气体,B是另一种气体,反应进行一段时间后,装置己中有红棕色气体生成。
实验中所用的药品和干燥剂只能从下列物质中选取:Na2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和双氧水、蒸馏水。(戊中电阻丝为铂丝,反应开始后断开K)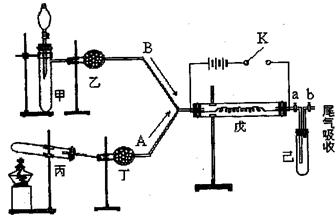
根据图中装置和反应现象请回答:
(1)丙中发生反应的化学方程式为:;
丁中的干燥剂应选:
(2)甲中发生反应的化学方程式为:____。
(3)戊中发生的主要反应是反应(填“吸热”或“放热”),可能发生的什么现象可以证明你的判断?
(4)当己中充满红棕色气体后,停止给丙加热,并关闭a、b两个活塞,若将己浸入冰水中,则己中会出现的现象是,简述产生此现象的原因。
(一)元素X、Y、Z和W的质子数依次增大,都不超过20。X的原子半径是元素中最小的,Z元素的非金属性是元素中最强的,Y原子的最外层达到稳定结构所需的电子数恰好等于内层的电子数。W元素的原子结构中,K层、L层的电子数之和等于M层、N层的电子数之和。
请用文字和化学用语回答下列问题:
(1) X2Y分子形状是,是____分子(填“极性”或“非极性”)。
(2)用电子式表示化合物WZ2的形成过程。
XZ在X2Y中可以任意比例溶解,原因是。
(3)写出由这些元素组成的物质之间发生的一个置换反应。
(二)氮是地球上含量丰富的一种元素,氮及其化合物在工量农业生产、生活中有着重要作用。请回答下列问题:
右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式。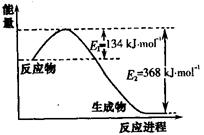
归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
| 性质\元素 |
8O |
16S |
34Se |
52Te |
| 单质熔点(℃ |
—218。4 |
113 |
450 |
|
| 单质沸点(℃) |
—183 |
444.6 |
685 |
1390 |
| 主要化合价 |
—2 |
—2,+4,+6 |
—2,+4,+6 |
|
| 原子半径 |
逐渐增大 |
|||
| 单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据上表回答下列问题:
(1)晶体硫属于晶体,硒的焙点T的范围可能是。
(2)碲的化合价可能有。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是(填化学式)。
(4)氢硒酸有较强的(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为。
(5)工业上Al2Te3可用来制各H2Te,完成下列化学方程式:
Al2Te3+()一A1(OH)3↓+H2Te↑
将a mol Na2O2与b mol NaHCO3混合共热到300℃,充分反应后(不与外界物质发生反应)得到固体和气体的成分,随着a与b的比值不同而不同,当a与b的比值为下列数值时,把得到的固体和气体的化学式填入下表:
| a/b |
固体物质的成分 |
气体物质的成分 |
| <1/2 |
||
| =1/2 |
||
| =1/1 |
||
| >1/1 |