锌是一种常用金属,冶炼方法有火法和湿法。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
(1)Ga的原子结构示意图为____________________。
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为_____________________。
(3)下列有关镓和镓的化合物的说法正确的是____________________(填字母序号)。
| A.一定条件下,Ga可溶于盐酸和氢氧化钠 |
| B.常温下,Ga可与水剧烈反应放出氢气 |
| C.Ga2O3可由Ga(OH)3受热分解得到 |
| D.一定条件下,Ga2O3可与NaOH反应生成盐 |
II.工业上利用锌焙砂(主要含Zn0、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示,回答下列问题:
已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式________________。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_____________________________________________________。
(6)净化II中加入Zn的目的是______________________________________________。
(7)常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_______________。
已知:Ksp[Fe(OH)3] =" 8.0" × 10-38;lg5 = 0.7
火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。其中被还原的元素是,被氧化的元素是,氧化剂是,还原剂是,氧化产物是,还原产物是。
483g Na2SO4·10H2O中所含的Na+的物质的量是和SO42—的物质的量是,所含H2O分子的数目是个。
若某原子的摩尔质量是M g /mol,则一个该原子的真实质量是g。
在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g)  a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为。
(2)写出该反应平衡常数K的表达式(a必须用具体的值表示)。
(3)下列说法中能说明该反应达到了化学平衡状态的是。
A:容器内压强一定 B:容器内气体的密度一定
C:容器内Z分子数一定 D:容器内气体的质量一定
(4)X的转化率α= (用含Q、Q1的代数式表示)。
(5)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1kJ的是(稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W
D.2 molX、1mol Y、1molZ
(6)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了10%,则反应中放出的热量为kJ。
已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ |
200 |
250 |
300 |
350 |
| 平衡常数K |
9.94 |
5.2 |
1 |
0.5 |
试回答下列问题
(7)在300℃发生上述反应,以表中的物质的量投入到相同的恒容反应器中,其中向正反应方向转化的有(选填 A.B.C.D.E)。
| n(X) |
n(Y) |
n(Z) |
n(W) |
|
| A |
1 |
5 |
2 |
3 |
| B |
2 |
2 |
1 |
1 |
| C |
3 |
3 |
0 |
6 |
| D |
0.5 |
2 |
1 |
1 |
| E |
1 |
0.3 |
2 |
2 |
(8)若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为℃。
(9)在(8)小题达平衡后,保持温度和容器体积不变,分别向容器中再加入 A.2 mol X和1 mol Y, B.1mol Z和1 mol W, C.1molX , D.1 mol W至新平衡,则和原平衡相比,X的转化率A、B、C、D。(选填增大,减小,不变)
(10)维持T℃条件不变,若在一个和原容器体积相等的恒压容器N 中,加入2 mol X和1 mol Y发生如上反应并达平衡,则(选填M或N)容器中的反应先达到平衡状态,容器中X的质量分数MN(选填>、<、=符号)。
含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO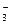 还原为N2,从而消除污染。其反应的离子方程式是:
还原为N2,从而消除污染。其反应的离子方程式是:
6NO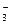 +10Al+18H2O=3N2↑+10Al(OH)3+6OH-
+10Al+18H2O=3N2↑+10Al(OH)3+6OH-
(1)上述反应中,生成标准状况下11.2L氮气时,转移的电子为mol。现在要除去1m3含氮元素0.4mol的废水中的N0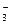 (设氮元素都以NO
(设氮元素都以NO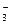 的形式存在,下同),则至少需要消耗金属铝g。
的形式存在,下同),则至少需要消耗金属铝g。
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
①写出镁和含氮废水反应的离子方程式
②已知金属镁可以从海水中提取的MgCI2通过电解制得的,电解熔融氯化镁的化学方程式为,若要除去1m3含氮元素0.3mol的废水中的NO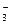 ,则至少需要含0.5%(质量分数)MgCl2的海水kg。
,则至少需要含0.5%(质量分数)MgCl2的海水kg。